Мужской гипогонадизм (обзор).
02.06.14, посмотрело: 25 794
Мужской гипогонадизм встречается примерно у 4-5 миллионов мужчин. По статистике, которая не может не ошеломлять, лишь 5% этих людей получают специализированное лечение.
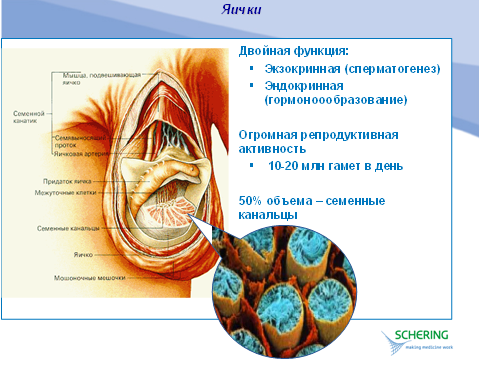
Мужским гипогонадизмом называют клинический и/или лабораторный синдром, который является результатом недостаточной функции яичек. Нормальные яички имеют две функции: синтез и секреция тестостерона клетками Лейдига и выработка сперматозоидов в семенных канальцах. Устойчивую недостаточность хотя бы одной из этих функций можно обозначить как гипогонадизм. Однако классическим мужским гипогонадизмом принято считать устойчивую недостаточность образования тестостерона в клетках Лейдига или недостаточность его биологического действия с развитием специфического клинического синдрома.
Физиологическое действие андрогенов
Эндогенные андрогены, в том числе тестостерон и его метаболит дигидротестостерон (ДГТ), в разные периоды жизни выполняют различные функции. В период эмбрионального развития андрогены играют ключевую роль в дифференциации мужских половых органов - простаты, семенных пузырьков, полового члена и мошонки.
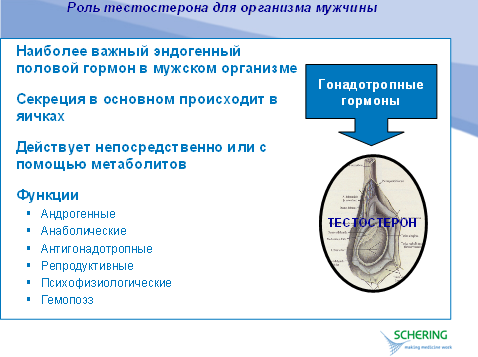
В пубертатный период андрогены отвечают за запуск процесса полового созревания. Тестостерон необходим для стимулирования сексуального поведения и сексуальных функций, инициации образования спермы и развития мужских вторичных половых признаков: специфического оволосения тела (на лице, лобке, груди, в области подмышек), увеличения гортани и утолщения голосовых связок. Андрогены также вызывают скачок роста в подростковом периоде и возможную остановку роста вследствие закрытия эпифизарных зон роста. В период зрелости андрогены необходимы для поддержания репродуктивных функций и вторичных мужских половых признаков. Кроме того, тестостерон влияет на мышечную массу и силу, распределение жировой ткани, костную массу, эритропоэз, сперматогенез, а также на половое влечение и потенцию. Более того, андрогены могут оказывать неспецифическое влияние на общий метаболизм, настроение и самочувствие. Таким образом, андрогены не только играют важнейшую роль в росте и развитии юноши, но и участвуют в поддержании здоровья мужчины в зрелые годы.
Биосинтез и превращение тестостерона
Тестостерон - преобладающий андроген в плазме крови мужчины - вырабатывается преимущественно (95%) яичками из холестерина, а также, в значительно меньших количествах, - корой надпочечников. В свою очередь, предшественник тестостерона, холестерин, может вырабатываться de novo в клетках Лейдига либо получаться из липопротеинов плазмы. В яичках откладывается лишь незначительное количество тестостерона. Таким образом, полный оборот тестостерона в крови происходит около 200 раз в сутки, а ежесуточный объем выделения тестостерона в плазму крови составляет приблизительно 6 мг.
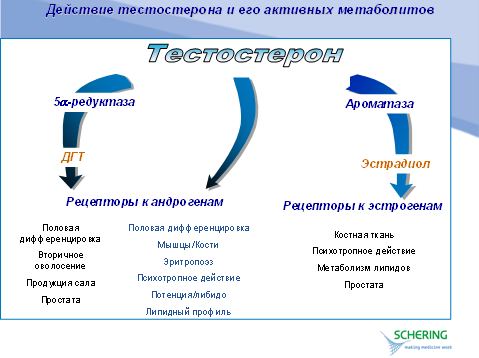
Поступая в кровоток, тестостерон транспортируется в плазме при помощи секс-стероид связывающего глобулина или в связанном с альбумином или другими белками виде; лишь небольшая часть его остается в свободной форме в динамическом равновесии со связанными фракциями. Циркулирующий в плазме тестостерон по большей части преобразуется в дигидротестостерон в тканях-мишенях (в том числе в коже, печени, предстательной железе) под воздействием фермента 5.-редуктазы. Тестостерон также метаболизируется в эстрадиол при посредстве ароматазного ферментного комплекса в яичках, головном мозге и жировых тканях.
Гипоталамо-гипофизарно-яичковая ось
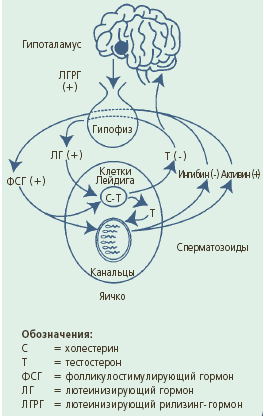
Производство тестостерона контролируется гипоталамо-гипофизарно-яичковой осью. Импульсные выбросы из гипоталамуса гонадотропин-рилизинг гормоном, стимулирует выделение гипофизом лютеинизирующего и фолликулостимулирующего гормонов. Что касается основных воздействий этих гонадотропинов в мужском организме, то лютеинизирующий гормон стимулирует производство тестостерона клетками Лейдига и способствует развитию яичек, а фолликулостимулирующий гормон совместно с тестостероном регулирует сперматогенез и созревание сперматозоидов. Тестостерон регулирует выделение лютеинизирующего и фолликулостимулирующего гормонов посредством отрицательной обратной связи гипоталамуса и гипофиза. Кроме того, выделение фолликулостимулирующего гормона избирательно тормозится ингибином - полипептидом, который производят клетки Сертоли, находящиеся в яичках, и стимулируется активином.
Лютеинизирующий гормон стимулирует продукцию тестостерона клетками Лейдига. После секреции яичками тестостерон в кровеносном русле взаимодействует по принципу обратной связи с гипоталамо-гипофизарной системой и, таким образом, тормозит выделение лютеинизирующего гормон. Это классическое физиологическое взаимодействие служит для поддержания сывороточного тестостерона на необходимом уровне. Если уровень сывороточного тестостерона падает ниже определенного, происходит стимуляция гипофиза, который секретирует лютеинизирующий гормон, тот, в свою очередь, стимулирует выделение яичками тестостерона, пока содержание тестостерона в сыворотке крови не достигнет необходимого значения. Наоборот, если содержание сывороточного тестостерона превышает необходимый уровень, пониженное выделение лютеинизирующего гормона снижает секрецию яичками тестостерона до тех пор, пока концентрация тестостерона в сыворотке крови не снизится до нужного значения.
Регуляция спермообразующей функции является более сложной и значительно менее понятной, чем регуляция уровня тестостерона. Предположительно, клетки Сертоли внутри семенных канальцев играют важную координирующую роль.
Фолликулостимулирующий гормон, как считают, усиливает сперматогенез, действуя через клетки Сертоли. Одновременно фолликулостимулирующий гормон стимулирует высвобождение полипептидного гормона (ингибина) из клеток Сертоли в кровоток. Циркулирующий ингибин тормозит выделение фолликулостимулирующего гормона по принципу обратной связи. Если интенсивность сперматогенеза уменьшается, то продукция ингибина должна также уменьшаться, таким образом, эффект обратной связи на гипофиз будет меньше. Это снижение секреции ингибина должно привести к увеличению выделения фолликулостимулирующего гормона, который затем стимулирует сперматогенез через клетки Сертоли. Однако не все аспекты этой обратной связи (фолликулостимулирующий гормон - ингибин - сперматогенез) были подтверждены экспериментально. В дополнение к взаимодействию фолликулостимулирующий гормон ингибин - сперматогенез, вероятно, также зависит от интратестикулярной продукции тестостерона.
Недостаточность тестикулярной функции может быть результатом дефекта яичек или возникает на гипоталамо-гипофизарном уровне.
Наиболее распространенные формы гипогонадизма и патологические процессы, при которых диагностируется гипогонадизм:
- Синдром Клайнфелтера - наиболее частая врожденная форма первичного гипогонадизма, встречается примерно у 0,1-0,2% родившихся живыми младенцев мужского пола.
- Среди мужчин с переломом костей тазобедренного сустава у 80% больных была отмечена низкая концентрация тестостерона. Действительно, наиболее частой вторичной причиной остеопороза у мужчин является гипогонадизм.
- Бесплодие - симптом, отмечаемый при мужском гипогонадизме, встречается у 5-10% больных. Считается, что от 40 до 60% всех случаев мужского бесплодия объясняется гипогонадизмом.
- Эректильная дисфункция - другой общий симптом снижения тестостерона у мужчин - поражает свыше 10 миллионов мужчин в одних в Соединенных Штатах. Сообщалось, что эндокринные нарушения, в основном гипогонадизм, ответственны за 5-35% случаев мужского бесплодия в выбранных популяциях.
- У 20-50% здоровых стареющих мужчин в возрасте от 50 до 70 лет концентрация биологически доступного тестостерона оказывается ниже нормальных величин для мужчин в возрасте от 20 до 40 лет.
Клиника гипогонадизма.
Симптоматика гипогонадизма, как первичного, так и вторичного, в первую очередь определяется недостаточностью основного мужского полового гормона - тестостерона и включает в себя следующие общие симптомы андрогенодефицита:
- Расстройства сексуальной функции:
- снижение либидо
- эректильная дисфункция
- расстройства оргазма
- расстройства эякуляции
- снижение фертильности эякулята
- Вегетососудистые расстройства:
- внезапная гиперемия лица, шеи, верхней части туловища
- чувство жара ("приливы")
- колебания уровня артериального давления
- кардиалгии
- головокружение
- чувство нехватки воздуха
- Психоэмоциональные расстройства:
- повышенная раздражительность
- быстрая утомляемость
- ослабления памяти и внимания
- бессонница
- депрессивные состояния
- снижение общего самочувствия и работоспособности
- Соматические расстройства:
- уменьшение количества мышечной массы и силы
- увеличение количества жировой ткани
- снижение плотности костной ткани
- гинекомастия
- появление или нарастание выраженности висцерального ожирения
- уменьшение количества волос на лице и теле
- истончение и атрофия кожи
Кроме того, при различных формах гипогонадизма существуют отдельные признаки и симптомы, характерные исключительно для данной патологии.
Классификация гипогонадизма
1. Первичный гипогонадизм (первичная тестикулярная недостаточность) обусловлен нарушением функции ткани яичка, тогда как вторичный гипогонадизм развивается вследствие гипоталамо-гипофизарной дисфункции.
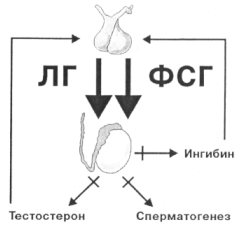
Первичный гипогонадизм - врожденная или приобретенная недостаточность яичек - вызывает дисфункцию в гипоталамо-гипофизарной системе, вследствие отсутствия адекватного ингибирующего влияния на гонадотропную функцию гипофиза тестостерона и ингибина.
В результате резко увеличивается синтез гонадотропных гормонов в кровоток - лютеинизирующего и фолликулостимулирующего. Поэтому первичный гипогонадизм еще называют гипергонадотропным.
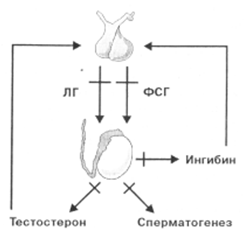
Врожденная или приобретенная гипоталамо-гипофизарная дисфункция приводит к недостаточности выработки гонадотропин-рилизинг гормона и/или гонадотропных гормонов, а значит недостаточной стимуляции гормонпродуцирующей и спермообразующей функции яичек. Такой гипогонадизм называют вторичным гипогонадизмом.
2. Как первичный, так и вторичный гипогонадизм могут быть врожденными, а могут возникнуть в процессе жизнедеятельности, т.е. быть приобретенными.
3. Кроме того, различают гипергонадотропный, гипогонадотропный и нормогонадотропный гипогонадизм.
При отсутствии патологии со стороны гипоталамо-гипофизарной системы и при повреждении тестикулярной ткани развивается гипергонадотропный гипогонадизм, который обусловлен повышенной секрецией гонадотропных гормонов гипофиза вследствие недостаточного торможения синтеза этих гормонов гормонам яичек.
При поражении гипоталамо-гипофизарной системы может возникнуть гипогонадотропный и нормогонадотропный гипогонадизм.
Гипогонадотропный гипогонадизм характеризуется низкой концентрацией в крови гонадотропных и тестикулярных гормонов, вследствие поражения гипофиза и/или гипоталамуса. Вследствие этой патологии уменьшается секреция гонадотропных гормонов и, как следствие отсутствия адекватной стимуляции тканей яичек, тестикулярных гормонов.
Нормогонадотропный гипогонадизм всегда связан с гиперпролактинемией и характеризуется нормальными цифрами гонадотропных гормонов и сниженными показателями тестикулярной функции. Механизм этого феномена до сих пор до конца остается неясным. Возможно это связано с развивающейся на фоне высоких цифр пролактина невосприимчивостью рецепторов яичек к гонадотропным гормонам.
Клинической формы гипогонадизма по материалам Jockenhovel F., 2004
Уровень поражения
Клиническая форма
Причина
Наличие
андро-
гено-
дефицита
Бесплодие
Гипоталамус (вторичный гипогонадизм)
Идиопатический гипогонадотропный гипогонадизм и синдром Каллманна
Конституциональное нарушение секреции ГнРГ
+
+
Синдром Паскуалини (изолированный дефицит ЛГ)
Дефицит ЛГ вследствие нарушения секреции ГнРГ
+
+/-
Изолированный дефицит ФСГ
Дефицит ФСГ вследствие нарушения секреции ГнРГ
-
+
Синдром Прадера-Вилли
Конституциональное нарушение секреции ГнРГ
+
+
Синдром Лоуренса-Муна-Барде-Бидля
Конституциональное нарушение секреции ГнРГ
+
+
Семейная мозжечковая атаксия
Конституциональное нарушение секреции ГнРГ
+
+
Конституциональная задержка пубертата
Конституциональное нарушение секреции ГнРГ
+
+
Вторичные расстройства секреции ГнРГ
Опухоли, инфильтрации, травмы, радиотерапия, недостаточное питание, сосудистые поражения, медикаменты, инфекции
+
+
Гипофиз (вторичный гипогонадизм)
Гипопитуитаризм
Инфильтрации, аденома, ишемия, синдром пустого турецкого седла, радиотерапия, оперативные вмешательства, медикаменты
+
+
Гиперпролактинемия
Аденома, медикаментозная терапия
+
+
Биологически неактивный ЛГ
Мутация гена ЛГ
+
+
Тестикулы (первичный гипогонадизм)
Анорхизм
Врожденный или приобретенный в результате травмы или операции
+
+
Чистая дисгенезия гонад
Дефект Y-хромосомы (?)
+
+
Смешанная дисгенезия гонад
Задержка развития тестикул, расстройства синтеза в тестикулах плода (?)
+
+
Персистенция Мюллеровых протоков
Отсутствие анти-мюллерова гормона
-
-/+
Аплазия герминальных клеток (синдром наличия только клеток Сертоли)
Конституциональные или приобретенные (радиотерапия, медикаменты, инфекции)
-
+
Аплазия клеток Лейдига
Мутация гена рецептора ЛГ
-
+/-
Мужской псевдогермафродитизм
Дефект ферментов биосинтеза тестостерона
+
+
Синдром Клайнфельтера
Хромосомная аберрация
+
+
XYY-синдром
Хромосомная аберрация
+/-
+/-
Синдром ХХ-мужчины
Неполная транслокация части Y-хромосомы
+
+
Синдром Нунан (45 ХО)
Неполная транслокация части Y-хромосомы
+
+
Опухоли яичка
Неизвестна
+
+
Варикоцеле (тяжелая форма)
Нарушение притока крови к яичку в результате венозной недостаточности
-/+
-/+
Орхит
Инфекции
-/+
-/+
Глобозооспермия
Нарушения сперматогенеза
-
+
Биологически неактивный ФСГ
Мутация гена ФСГ
-
+
Синдром неподвижных ресничек
Нарушения сперматогенеза
-
+
Идиопатическое бесплодие
Неизвестна
-
+
Системные заболевания
Почечная недостаточность, гемохроматоз, цирроз печени, ВИЧ-инфекция и др.
+
+
Экзогенные токсины
Медикаменты, облучение, алкоголь
+
+
Органы-мишени андрогенов
Тестикулярная феминизация
Дефект гена рецептора андрогенов с полной потерей функции
+
+
Частичная тестикулярная феминизация
Дефект гена рецептора андрогенов с различной потерей функции
+
+
Синдром Рейфенштейна
Дефект гена рецептора андрогенов с частичной потерей функции
+
+
Бесплодие в сочетании с резистентностью к андрогенам
Дефект гена рецептора андрогенов с легкой потерей функции
-
+
Перинеоскротальная гипоспадия и псевдовагина
Мутация гена 5-альфа-редуктазы
+
+
Недостаточность ароматазы
Дефект гена ароматазы
-
+/-
Резистентность к эстрогенам
Дефект гена эстрогенового рецептора
-
+/-
Диагностика гипогонадизма.
I. Оценка гормонпродуцирующей функции клеток Лейдига:
- общий тестостерон сыворотки крови
- лютеинизирующий гормон и гонадолиберин сыворотки крови
II. Оценка спермообразующей функции яичек:
- исследование семенной жидкости (см. раздел «Бесплодие»)
- ингибин В сыворотки крови
- антимюллеровский гормон сыворотки крови
- фолликулостимулирующий гормон сыворотки крови
III. Оценка транспортной функции тестостерона
IV. Оценка активности тестостерона:
- свободный тестостерон сыворотки крови и в слюне
- расчет биологически активного тестостерона
- методы косвенной оценки андрогенной насыщенности организма
V. Оценка рецепторов к андрогенам органов-мишеней.
VI. Оценка гормональных резервов гормонпродуцирующих органов репродуктивной системы:
- Оценка гормональных резервов яичек (проба с хорионическим гонадотропином человека)
- Оценка гормональных резервов лютеинизирующего и фолликулостимулирующего гормонов.
VII. Оценка андрогенпродуцирующей функции надпочечников:
- Дегидроэпиандростерона - сульфат сыворотки крови
- 17-кетостероиды суточной мочи
VIII. Оценка эстрогенного баланса.
- эстрадиол сыворотки крови
IX.Оценка пролактинпродуцирующей функции гипофиза.
I. Оценка гормонпродуцирующей функции клеток Лейдига
Общий тестостерона
Поскольку в различных лабораториях нормы существенно отличаются, результаты анализов каждого пациента следует оценивать с позиции норм, установленных именно той лабораторией, в которой производилось определение. У здорового человека секреция тестостерона имеет выраженный циркадный ритм с максимальными уровнями гормона в ранние утренние часы, и минимальные - в 15:00-17:00. Большинство авторов рекомендует измерение уровня тестостерона в ранние утренние часы, с 8.00 до 11.00.
Кроме того, необходимо помнить, что в некоторых случаях клиническая картина гипогонадизма может сопровождаться нормальными или повышенными показателями тестостерона (синдром тестикулярной феминизации, дефицит 5-альфа-редуктазы).

В целом принято считать для молодых мужчин являются патологическими уровень общего тестостерона менее 12 ммоль/л.
Лютеинизирующий гормон.
Лютеинизирующий гормон является гонадотропным гормоном передней доли гипофиза, который определяет функциональное состояние клеток Лейдига яичек, он стимулирует выработку тестостерона у мужчин, благодаря чему происходит и созревание сперматозоидов. Лютеинизирующий гормон также стимулирует образование белков, связывающих половые гормоны, повышает проницаемость семенных канальцев для тестостерона.
Норма лютеинизирующего гормона у мужчин 1,84-8,16 мМЕ/л
Повышенный лютеинизирующий гормон в крови обычно означает:
- недостаточность функции половых желез
- опухоль гипофиза
- почечная недостаточность
Повышение лютеинизирующего гормона происходит при голодании, спортивных тренировках и как следствие перенесенного стресса.
Снижение лютеинизирующего гормона происходит при гипофункции гипофиза или гипоталамуса, при генетических синдромах, ожирении, курении и стрессе. Низкий лютеинизирующий гормон в крови - проявление нервной анорексии.
Мужчины могут сдавать анализ крови в любой день. Забор крови производится строго натощак.
Гонадотропин-рилизинг гормон.
Гонадолиберин - это нейропептид, образуется в гипоталамической системе. И стимулирующий образование клетками гипофиза. Гонадотропин-рилизинг гормон секретируется в портальную венозную систему гипофиза, где он стимулирует образование и пульсирующую секрецию лютеинизирующего и, в меньшей степени, фолликулостимулирующего гормона. Уровень гонадотропин-рилизинг обладает очень коротким периодом полужизни (менее 10 минут) и задерживается главным образом гипофизом, где под действием пептидазных систем быстро распадается. Расшифровка первичной структуры этого гормона принесла в 1977 году А. Шелли Нобелевскую премию, что позволило создать лекарственные аналоги.
Уровень гонадотропин-рилизинг гормона в сыворотке периферической крови ниже пределов чувствительности иммунологических методов.
Для выяснения гонадотропных резервов гипофиза и недостаточности гипоталамуса проводятся тесты с антиэстрогенными препаратами и аналогами гонадотропин-рилизинг гормона.
II. Оценка спермообразующей функции яичек:
Ингибин В.
Ингибин B принадлежит суперсемейству гормонов ингибинов и активинов, в которое входят также антимюллеровский гормон и трансформирующий фактор роста TGF-β.
Ингибины - гетеродимерные белковые гормоны, секретируемые клетками Сертоли в яичках у мужчин. Ингибин - пептид с молекулярной массой 32 кDa, состоящий из α-субъединицы и β-субъединицы, связанных дисульфидными мостиками. Главной формой циркулирующего в крови ингибина у мужчин является ингибин В. Ингибин селективно ингибирует освобождение фолликулостимулирующего гормона из передней доли гипофиза. Его концентрация в сыворотке у мужчин коррелирует обратно пропорционально с концентрацией фолликулостимулирующего гормона.
Клиническими исследованиями установлено, что ингибин В - более ценный маркер гаметогенеза по сравнению с гипофизарным фолликулостимулирующего гормона по следующим основным причинам:
- Ингибин В - прямой маркёр гаметогенеза, т.к. синтезируется гонадами. Уровень ингибина В в крови непосредственно отражает секрецию ингибина В клетками Сертоли в яичках у мужчин. Сниженный уровень ингибина В указывает на снижение спермообразующей функции яичек т.к именно клетки Сертоли тесно связаны со сперматогенезом.
- Ингибин В - независимый маркёр гаметогенеза, так как не зависит от уровня эстрадиола, главного эстрогенного гормона, синтезируемого гонадами. Уровень фолликулостимулирующего гормона снижается при повышении концентрации эстрадиола в крови.
- Совместное измерение ингибина B и фолликулостимулирующего гормона - лучший индикатор адекватного или нарушенного сперматогенеза по сравнению с любым из маркёров по отдельности.
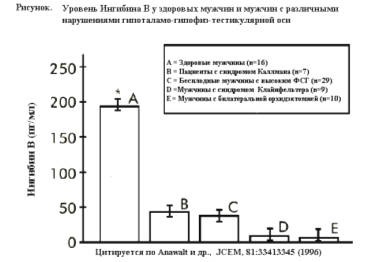
Ингибин В является прямым маркером функции клеток Сертоли и сперматогенеза. Его концентрация у здоровых мужчин обычно меньше 480 пг/мл, и она постоянна, не носит циклических колебаний. Однако при бесплодии уровень ингибина В может быть снижен. Было показано, что у 100% обследованных с содержанием сперматозоидов в сперме менее 20 млн/мл концентрация ингибина В в сыворотке была ниже 80,0 пг/мл, а ФСГ - выше 10 Ед/л.
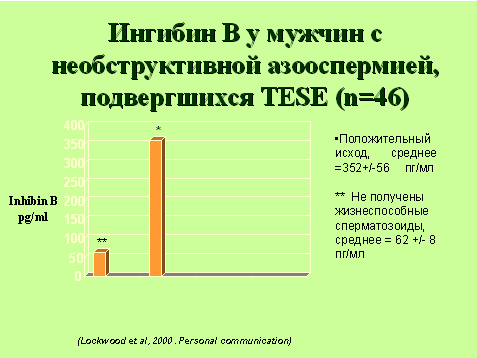
Ингибин B точно предсказывает успех процедуры TESE при азооспермии. Его низкая концентрация указывает на неадекватное производство спермы и может исключать хирургическую процедуру (TESE) для получения жизнеспособной спермы.
Ингибирующее вещество Мюллера - AMH/MIS
Ингибирующее вещество Мюллера - MIS (известное также как антимюллеров гормон - AMH), является димерным гликопротеином, принадлежащим к семейству β -трансформирующих факторов роста. В процессе эмбрионального развития он секретируется клетками Сертоли и отвечает за регрессию мюллеровых протоков у мужчин. До наступления половой зрелости АМН продуцируется яичками, а затем его уровень постепенно снижается до остаточных постпубертатных значений. Нарушение функции антимюллерова гормона вызывает у мужчин сохранение дериватов мюллеровых протоков. Это состояние клинически проявляется крипторхизмом, паховыми грыжами и нарушением репродуктивной функции и названо синдромом персистенции мюллеровых протоков (СПМП).
СПМП - редкая форма ложного мужского гермафродитизма. Несмотря на то, что у пациентов с СПМП не нарушена дифференцировка яичек, у них часто отмечают бесплодие. Бесплодие у пациентов с СПМП может быть вследствие поздно устраненного оперативными методами крипторхизма, приводящего к атрофии семенных канальцев и вторичной андрогенной недостаточности. Возникновение СПМП может быть обусловлено мутациями как гена антимюллерова гормона, так и гена рецептора антимюллерова гормона.
Оценка антимюллеровского гормона используется:
- в оценке мужской половой функции в любом возрасте
- для выявления преждевременного или замедленного полового созревания
- в установлении пола в сомнительных случаях,
- для дифференциальной диагностики крипторхизма и анорхизма
Нормативные значения антимюллерова гормона в сыворотке крови у здоровых мужчин пока не уточнены, однако в некоторых исследованиях в группах контроля концентрация этого гормона в сыворотке крови была равна 2,72±0,67 нг/мл.
Фолликулостимулирующий гормон.
Фолликулостимулирующий гормон является гонадотропным гормоном передней доли гипофиза, который определяет функциональное состояние клеток Сертоли яичек вместе с тестостероном и способствует образованию и созреванию сперматозоидов.
У мужчин фолликулостимулирующий гормон стимулирует рост семявыносящих канальцев, увеличивает уровень тестостерона в крови, тем самым, обеспечивая процесс созревания сперматозоидов и влияет либидо.
Нормативные значения фолликулостимулирующего гормона у взрослого мужчины - 1,37-13,58 мЕд/л
Высокий уровень фолликулостимулирующего гормона наблюдается:
- при недостаточности функции спермообразующей функции яичек и клеток Сертоли
- при алкоголизме
- при орхите
- при опухоли гипофиза
- при почечной недостаточности
- после воздействия рентгеновского излучения
Низкий уровень содержания фолликулостимулирующего гормона в сыворотке крови наблюдается при:
- гипофункции гипофиза или гипоталамуса
- ожирении
Обычно фолликулостимулирующий гормон понижен после хирургических вмешательств и как следствие приема некоторых медицинских препаратов, например анаболических стероидов.
Мужчины могут выполнять исследование на фолликулостимулирующий гормон в любой день строго натощак
III. Оценка транспортной функции тестостерона.
Глобулин, связывающий половые гормоны ( Sex hormone-binding globulin, SHBG)
Имеется несколько синонимов названия этого белка: секс-стероид связывающий глобулин, андроген-связывающий глобулин, половой стероид-связывающий глобулин, sex hormone-binding globulin. Этот гликопротеин, синтезирующийся в печени; молекулярный вес его около 80000 - 100000 дальтон, молекула имеет 1 связывающий участок для стероидных гормонов. Сродство SHBG к дегидротестостерону в 3 раза превышает сродство к тестостерону, а к эстрадиолу оказывается в 3 раза ниже, чем к тестостерону. Дегидроэпиандростерон и андростендион практически не связываются с этим белком. Связанные с SHBG андрогены труднодоступны для действия в тканях-мишенях.
Тестостерон циркулирует преимущественно в виде связанного с SHBG, в меньшей степени с альбумином и кортизол-связывающим глобулином.
SHBG служит своеобразной "буферной системой" - депо тестостерона в крови, доставляет половые гормоны от яичек к тканям-мишеням и распределяет их по организму. SHBG регулирует биологическую активность гормонов, уменьшает фракцию активного и биодоступного тестостерона и сдвигает равновесие в пользу эстрогенов.
В свою очередь, половые стероиды регулируют синтез SHBG: эстрогены стимулируют синтез SHBG в печени и увеличивают время его существования в циркуляции, а андрогены, напротив, оказывают ингибирующий эффект. Поэтому содержание SHBG у женщин почти вдвое выше, чем у мужчин.
Поскольку содержания белков-переносчиков может влиять на концентрацию биодоступного тестостерона в циркуляции, содержание SHBG обычно определяют в дополнение к измерению общего тестостерона. При снижении продукции андрогенов увеличение продукции SHBG обуславливает сохранение на постоянном уровне общего тестостерона, хотя концентрация свободного гормона при этом снижается. Поэтому уровень общего тестостерона плазмы может быть парадоксально нормальным при ранних стадиях тестикулярных заболеваний.
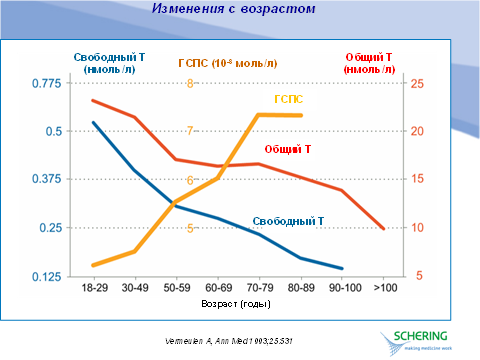
После 60 лет содержание SHBG растет примерно на 1,2 % в год, таким образом, с возрастом уровень биологически доступного тестостерона снижается в большей степени, чем уровень общего тестостерона.
Показания к назначению анализа:
- клинические признаки увеличения или снижения уровня андрогенов при нормальном уровне тестостерона
- облысение
- угревая сыпь
- жирная себорея
- выявление маркеров инсулинорезистентности
- синдром PADAM
- хронический простатит
- эректильная дисфункция
- снижение либидо
Нормативные значения мужчины: 13-71 нмоль/л; женщины: 28-112 нмоль/л;
Факторы и состояния, повышающие уровень SHBG:
-
-
-
- гиперэстрогения;
- гипертироидизм
- цирроз печени
- стресс
- гипергликемия
- конституциональные особенности
- возраст
- ВИЧ-инфекция
- прием препаратов, содержащих эстрогены; фенитоин.
-
-
Факторы и состояния, понижающие уровень SHBG:
-
-
-
- гиперандрогения, терапия андрогенами/прогестинам
- гипотироидизм
- болезнь Кушинга, адреногенитальный синдром и повышенная концентрация глюкокортикоидов в крови
- гиперпролактинемия
- ожирение
- акромегалия и повышенная концентрация гормона роста
- нефротический синдром
- большие коллагенозы
- инсулинорезистентность
- цирроз печени
-
-
Подготовка исследованию крови - строго натощак.
IV. Оценка активности тестостерона:
Свободный тестостерон сыворотки крови.
Свободный тестостерон - это биологически активная часть тестостерона крови.
Большая часть циркулирующего в крови тестостерона связана с SHBG и в связанной с транспортными белками форме гормон неактивен и недоступен для метаболической инактивации. В тех ситуациях, когда SHBG повышен (например, гипертиреоидизм, состояния гиперэстрогении, введение противоэпилептических средств) или понижен (например, гипотиреоидизм, избыток андрогенов, ожирение), измерение свободного тестостерона может быть более целесообразным, чем определение общего тестостерона.
Показания к назначению анализа
- Дополнительно к определению общего тестостерона в ситуациях, связанных с возможным измерением концентрации SHBG (ожирение, цирроз, заболевания щитовидной железы);
- Эректильная дисфункция
- Болезнь Альцгеймера
- Терапия антидепрессантами
Нормативные значения свободного тестостерона 180-970 пмоль/л. В целом принято считать для молодых мужчин являются патологическими уровень свободного тестостерона менее 250 пмоль/л.
Подготовка исследованию крови - строго натощак.
Свободный тестостерон в слюне.
По мнению Международной ассоциации андрологов, определение концентрации свободного тестостерона в слюне является также достаточно надежным подходом к исследованию уровня тестостерона. Свободный тестостерон проникает в слюну внутриклеточным путем, потому его концентрация там не зависит от скорости продукции слюны и близка к плазменной.
Уровень тестостерона в слюне коррелирует с концентрацией свободной фракции (не связанной с белками) тестостерона в крови и предоставляет информацию, аналогичную определению свободного тестостерона. Секреция тестостерона пульсовая, с пиком в 7 часов и минимумом в 20 часов, при этом концентрация тестостерона в плазме крови отражает только концентрацию на момент забора крови. Образцы, собранные в 2-3 интервала в течение периода бодрствования, обеспечивают точное определение концентрации тестостерона. Образец слюны может быть более полезен, чем любой образец плазмы для протоколов краткосрочного динамического контроля, так как сбор слюны - неинвазивный и недорогой способ.
Новый люминесцентный иммунный ферментный (ЛИФ) анализ был разработан недавно для определения концентрации стероидных гормонов, как в крови, так и в слюне. ЛИФ измеряет непосредственно концентрацию свободного гормона в слюне и является более точным методом, чем подсчет свободного тестостерона в плазме.
В 1980 Gaskell сообщил, что при использовании газовой хроматографии, значения тестостерона в слюне для нормального человека находятся в диапазоне 200 - 500 пмоль/л.
Методы расчета биологически активного тестостерона.
Для биодоступного тестостерона нормальным считается значение 3,8 нмоль/л. Метод расчета свободного и биодоступного тестостерона можно найти на веб-сайте ISSAM (www.issam.ch). Считается, что биологически активной, или "биодоступной" фракцией тестостерона является свободно циркулирующая фракция, и часть гормона, находящаяся в слабой связи с альбумином. В то время как часть тестостерона, связанная с SHBG , не проявляет своей биологической активности.
Индекс свободных андрогенов.
Малколм Каррузерс предлагает для определения содержания в крови биодоступного тестостерона, определять индекс свободных андрогенов. Он определяется следующим образом: общий уровень тестостерона в крови делится на уровень SHBG и умножается на 100. У молодых мужчин индекс свободного андрогена составляет от 70 до 100 процентов. Если он падает ниже 50, появляются признаки андропаузы.
Калькулятор расчета свободного и доступного тестостерона разработан в отделении гормонологии, University Hospital of Ghent, Бельгия.
Формула, по которой идет расчет биологически доступного тестостерона приведена ниже:
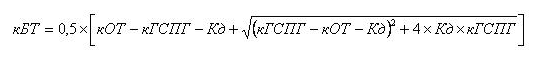
где кБТ - концентрация биологически доступного тестостерона
кОТ- концентрация общего тестостерона
кГСПГ- концентрация глобулина связывающего половые гормоны
Кд - константа диссоциации тестостерон/ ГСПГ комплекса (5,88 ± 1,54 х 109 M здоровых мужчин в возрасте 19-65 лет и 10,34 ± 2,76 х 109 M мужчин в возрасте 60-88 лет с клиническими признаками андрогенного дефицита). Для биодоступного тестостерона нормальным считается значение свыше 3,8 нмоль/л.
Кроме того, подсчет свободного и биодоступного тестостерона на основании общего тестостерона и SHBG-белка возможен методом Sodergard, методом Vermeulen, методом Emadi-Konjin, методом Morris и методом Ly.
Методы косвенной оценки андрогенной насыщенности организма.
Кристаллизация секрета простаты на стекле (феномен «папоротника»)
Это косвенный тест на андрогенную насыщенность организма. Высушенную каплю секрета простаты смачивают физиологическим раствором (капля на каплю). После высыхания оценивают количество "уровней" кристаллизации - симптом папоротника ("стволы", "ветви", "веточки" и т. д.). Запись производится по количеству максимально найденных перекрестий (уровней) кристаллизации (норма - +++ или ++++).
Подкожная проба Ригони и Гольяни.
Это также косвенный тест на андрогенную насыщенность организма.
В наружную поверхность верхней трети плеча п/к вводится стерильная смесь 0,3 мл масляного раствора 1 % тестостерона пропионата и 0,2 мл физиологического раствора.
Через 10-15 минут вокруг места инфекции появляется зона гиперемии, интенсивность которой пропорциональна степени андрогенной насыщенности организма.
В случае появления ярко-красной гиперемии, превышающей в размере диаметр более 30 мм, реакция оценивается как резко положительная.
- Яркая гиперемия диаметром 26-29 мм оценивается как положительная.
- Ярко-розовая зона гиперемии диаметром 10-14 мм расценивается как сомнительная.
- При отсутствии гиперемии реакция считается отрицательной.
V. Оценка рецепторов к андрогенам на органах-мишенях.
Скрининг на обнаружение мутации гена андрогенового рецептора производился методом DHPLC (denaturing high performance liquid chromatography) и определения генных последовательностей. Наибольшее количество мутаций было обнаружено в экзоне 1 гена андрогенового рецептора, кодирующего домен трансактивации белка.
VI. Оценка гормональных резервов гормонпродуцирующих органов репродуктивной системы:
Оценка гормональных резервов яичек (проба с хорионическим гонадотропином человека)
Гормональные резервы яичек можно оценить путем их стимуляции хорионическим гонадотропином человека. Хорионический гонадотропин человека обладает в основном активностью лютеинизирующего гормона и стимулирует продукцию тестостерона клетками Лейдига.
В первый день исследования между 8 и 10 часами утра берут кровь для определения базального уровня тестостерона.
Первая методика: внутримышечно одномоментно вводится хорионический гонадотропин человека в дозе 5000 МЕ. Последующие пробы крови берут через 48 и 72 часа. Уровень тестостерона должен возрасти в 1,5 -2,5 раза. Меньшее повышение указывает на первичный гипогонадизм, большее на вторичный.
Вторая методика: внутримышечно ежедневно в течение 5 суток вводится хорионический гонадотропин в дозе 2000 Ед. Пробы крови берутся на следующее утро после последней инъекции. Уровень тестостерона крови у нормальных мужчин повышается в 2-3 раза.
Оценка гормональных резервов лютеинизирующего и фолликулостимулирующего гормонов.
Проба с антиэстрогенами.
Эстрогены оказывают ингибирующее влияние на функцию гипоталамуса и образование гонадотропин-рилизинг гормона. Антиэстрогенные препараты (клостилбегит) ослабляют ингибирующее действие эстрогенов на функцию гипоталамуса, вызывая усиление образования гонадотропин-рилизинг гормона, который оказывает стимулирующее действие на аденогипофиз, усиливая продукцию в кровоток лютеинизирующего и фолликулостимулирующего гормона.
В разные дни берут кровь для определения базальных концентраций ЛГ и ФСГ.
Клостилбегит назначают внутрь в дозе 100 мг/сутки в течение 1 - 4 недель.
Далее кровь берут через неделю после начала приема клостильбегида, а затем 2 раза в неделю.
Концентрация лютеинизирующего гормона возрастает в 2 раза на 7-е сутки после начала приема клостильбегида и обычно продолжает увеличиваться в более поздние сроки. Уровень фолликулостимулирующего гормона повышается не так значительно, как уровень лютеинизирующего.
Отсутствие реакции на кломифен подтверждает дефицитлютеинизирующего и фолликулостимулирующего гормонов, но не позволяет дифференцировать патологию гипоталамуса и гипофиза. Если реакция на клостилбегит отсутствует, а реакция на гонадолиберин нормальная, дефицит лютеинизирующего и фолликулостимулирующего гормонов обусловлен патологией гипоталамуса. Проба с клостилбегитом не позволяет дифференцировать конституциональную задержку полового развития и изолированный дефицит гонадотропных гормонов, так как в препубертатном периоде в норме реакция на клостилбегит отсутствует.
Реакция на клостилбегит снижена при нервной анорексии и гиперпролактинемии.
Проба с гонадолиберином.
Гонадолиберин стимулирует секрецию лютеинизирующего и фолликулостимулирующего гормонов. В исследовании используют синтетический аналог гонадолиберина -гонадорелин (нафарелин).
В вену устанавливают иглу-бабочку или катетер. Поскольку секреция лютеинизирующего и фолликулостимулирующего гормонов имеет импульсный характер, кровь для определения базальных концентраций этих гормонов берут перед началом пробы дважды: за 15 мин до введения и непосредственно перед введением гонадорелина. Базальные концентрации рассчитывают как средние значения двух измерений.
Гонадорелин в дозе 100 мкг вводят быстро в/в струйно. Через 15, 30, 45, 60, 90 и 120 мин после введения гонадорелина берут кровь и определяют концентрации лютеинизирующего и фолликулостимулирующего гормонов в сыворотке.
Как правило, усиление секреции лютеинизирующего гормона более выражено и происходит раньше, чем усиление секреции фолликулостимулирующего гормона. У взрослых концентрация лютеинизирующего гормона увеличивается более чем в 2-3 раза и достигает максимума в интервале 15-45 мин после введения гонадорелина. Концентрация фолликулостимулирующего гормона обычно возрастает в 1,5-2 раза, а иногда не изменяется. Однократная проба не всегда позволяет отличить патологию гипофиза от патологии гипоталамуса, поскольку снижение или отсутствие секреторной реакции наблюдаются как при заболеваниях гипофиза, так и при хроническом дефиците гонадолиберина.
При подозрении на гипоталамические расстройства и при отсутствии подъема гонадотропинов в ходе первой пробы с гонадолиберином, его следует повторить после импульсного введения гонадорелина с помощью дозатора "Цикломат" - по 5 мкг каждые 120 минут на протяжении от 1,5 до 7 суток. Заметный подъем гонадотропинов в ходе повторной пробы через 7 суток, указывает на патологию гипоталамуса, а отсутствие такого подъема характерно для недостаточности гипофиза.
Проба позволяет выявить дефицит лютеинизирующего и фолликулостимулирующего гормонов и нарушения секреторной реакции на гонадолиберин. Повторная проба позволяет отличить конституциональную задержку полового развития от идиопатического гипогонадотропного гипогонадизма.
У некоторых больных с установленной патологией гипофиза или гипоталамуса наблюдается нормальная секреторная реакция. Это означает, что гонадотропные клетки аденогипофиза сохраняют способность к стимулированной секреции лютеинизирующего и фолликулостимулирующего гормонов.
Проба не позволяет оценить секрецию лютеинизирующего и фолликулостимулирующего гормонов у детей препубертатного возраста, поскольку гипоталамо-гипофизарно-гонадная система у них еще не созрела. В препубертатном возрасте базальные уровни лютеинизирующего и фолликулостимулирующего гормонов низкие, а реакция гонадотропных клеток на гонадолиберин практически отсутствует.
Значительное усиление секреции лютеинизирующего гормона в ответ на гонадолиберин наблюдается у мужчин при первичном гипогонадизме.
Побочные эффекты. Иногда во время пробы возникает сильная жажда.
VII. Оценка андрогенпродуцирующей функции надпочечников:
Дегидроэпиандростерон-сульфат.
Вырабатывается в коре надпочечников. Уровень этого гормона является адекватным показателем андрогенпродуцирующей активности надпочечников. Гормон обладает лишь слабым андрогенным действием, однако, в процессе его метаболизма в периферических тканях образуются тестостерон и дигидротестостерон. Не обнаруживает заметных суточных колебаний и имеет низкую скорость клиренса.
Определение ДГЭА-S заменяет определение 17-КС в моче при оценке выработки надпочечниками андрогенов.
Показания к назначению исследования:
- Адреногенитальный синдром
- Опухоли коры надпочечников
- Эктопические АКТГ-продуцирующие опухоли
Референсные значения: мкмоль/л
Возраст
Мужчины
< 9 лет
0,1 - 5,0
9-10 лет
0,3 - 2,6
10-11 лет
0,4 - 2,0
11-12 лет
0,5 - 4,1
13-14 лет
0,6 - 6,6
14-20 лет
0,6 - 9,7
20-30 лет
7,6 - 17,4
30-40 лет
3,3 - 14,1
40-50 лет
2,6- 14,4
50-60 лет
1,9 - 8,4
60-70 лет
1,1 - 7,9
>70 лет
0,8 - 4,7
Повышение уровня дегидроэпиандростерон-сульфат:
- Адреногенитальный синдром
- Опухоли коры надпочечников
- Эктопические АКТГ-продуцирующие опухоли
- Болезнь Кушинга
Снижение уровня дегидроэпиандростерон-сульфат:
- Гипоплазия надпочечников
- Прием препаратов
Подготовка к исследованию крови - строго натощак.
17-кетостероиды в моче.
17- кетостероиды мочи - это продукты метаболизма мужских половых гормонов, выделяющихся с мочой. У мужчин только 1/3 общего количества выделяющихся с мочой 17- кетостероидов имеют яичковое происхождение, около 10% - являются конечным продуктом метаболизма глюкокортикоидов. Основная часть 17- кетостероидов является продуктом метаболизма андрогенов надпочечников, главным из которых дегидроэпиандростерон.
Уровень суточной экскреции 17- кетостероидов в целом более стабилен, чем содержание андрогенов в плазме, так как секреция андрогенов имеет выраженный циркадный ритм. Поэтому определение 17-кетостероидов в суточной моче иногда используют в клинической практике для оценки выработки андрогенов корой надпочечников, в том числе при выявлении причин бесплодия. В этих же целях в настоящее время чаще используют определение в сыворотке крови дегидроэпиандростерона - сульфата, так как этот гормон точно отражает продукцию дегидроэпиандростерона.
Резкое повышение экскреции 17- кетостероидов с мочой отмечается при опухолях или гиперплазии надпочечников.
Умеренное повышение выделения 17- кетостероидов отмечается у людей с ожирением. Острый физический или эмоциональный стресс, прием разных видов лекарственных препаратов может повлиять на результаты исследования.
Показания к назначению исследования:
- Оценка секреции андрогенов надпочечниками
- Диагностика адреногенитального синдром
- Диагностика карциномы надпочечников
Референсные значения: мг/сут
ВозрастУровень 17-КС 1 - 5 лет<2,05 - 9 лет<3,09-12 лет1,0-6,014-16 лет3,0-13,0Взрослые мужчины10,0-25,0 Повышение уровня 17 кетостероидов в моче:
- Опухоли с эктопической продукцией адренокортикотропного гомона
- Опухоли надпочечников
- Вирилизующие формы врожденной гиперплазии надпочечников (адреногенитальный синдром)
- Опухоли яичка, интерстициально-клеточные опухоли
- Болезнь Иценко-Кушинга
- Стресс
- Использование лекарственных препаратов, таких как: цефалоспорины, эритромицин, кетопрофен, спиронолактон, дексаметазон и др.
Снижение уровня 17- кетостероидов:
- Болезнь Аддисона
- Гипопитуитаризм
- Гипотиреоз
- Общие тяжелые заболевания;
- Хроническая почечная недостаточность
- Первичный гипогонадизм у мужчин
- Прием таких лекарственных препаратов, как эстрогены, пробенецид, фенитоин, пиразинамид.
Подготовка к исследованию.За 3 дня, по возможности, следует отменить прием лекарственных препаратов. За сутки до сбора мочи нельзя употреблять в пищу продукты, способные ее окрасить (например, свеклу, морковь и т.п.). Также не следует принимать алкоголь и есть острую пищу.
Моча собирается в течение суток. Первая утренняя порция мочи удаляется, все последующие порции мочи, выделенные в течение дня, ночи и утренняя порция следующего дня собираются в одну емкость, которая хранится в холодильнике (+4 +8 С) в течение всего времени сбора. Это необходимое условие, так как при комнатной температуре существенно снижается содержание глюкозы. Собранную мочу перемешивают, измеряют общий объем, в лабораторию необходимо доставить 100-200 мл мочи с указанием общего объема мочи, собранной за сутки.VIII.Оценка эстрогенного баланса. Эстрадиол. Наиболее активный женский половой стероидный гормон. У мужчин в возрасте до 50 лет 20 % эстрадиола секретируется яичками, 60 % образуется в процессе ароматизации тестостерона, а остальные 20 % - при восстановлении эстрона. В возрасте между 50 и 60 годами доля эстрадиола, синтезируемая яичками, относительно возрастает вследствие резкого снижения секреции андрогенов корой надпочечников. Показания к назначению анализа:
- Признаки феминизации у мужчин.
- Гинекомастия и галакторея
Референсные значения: пмоль/л
Эстрадиол
пг/мл
пмоль/л
Мужчины
<56
40-161
Повышение уровня эстрадиола:
- Эстрогенсекретирующая опухоль яичек
- Цирроз печени
- Прием таких препаратов, как анаболические стероиды, карбамазепин, циметидин, кетоконазол, фенитоин, тамоксифен, тролеандомицин, вальпроевая кислота
Снижение уровня эстрадиола:
- Тестикулярная феминизация
- Гиперпролактинемия
- Гипофизарный нанизм
- Хронический простатит
- Прием таких препаратов, как: аминоглютетимид, бузерелин, химиотерапевтические препараты, циметидин, ципротерон, даназол, дексаметазон, эпостан, мегестрол, моклобемид, нафарелин, нандролон, октреотид
Подготовка к исследованию: накануне исследования исключить физические нагрузки (спортивные тренировки) и курение. Исследованию крови утром - строго натощак.
IX.Оценка пролактинпродуцирующей функции гипофиза.
Пролактин.
Пролактин вырабатывает гипофиз. Пролактин у мужчин способствуют выработке тестостерона, а также образованию и правильному развитию сперматозоидов.
При отсутствии стресса пролактин и его уровень находятся в пределах нормы. На уровень пролактина эстрогены оказывают прямое влияние. Тем более высокий пролактин, чем более высокий уровень эстрогенов синтезируется в организме. В норме повышение пролактина происходит во время сна, физической нагрузки, полового акта.
Референсные значения: мЕд/л
Уровень пролактинаМужчины53-360 Повышение уровня пролактина:
- дисфункции, опухоли гипофиза
- заболевания гипоталамуса
- гипотиреоз
- почечная недостаточность
- цирроз печени
- аутоиммунные заболевания - ревматоидный артрит, диффузный токсический зоб, системная красная волчанка и т.д
- гиповитаминоз В6
- стресс
- повреждения грудной клетки
- прием антигистаминных препаратов, эстрогенов и некоторых других лекарств
Постоянно повышенный уровень пролактина в крови называется гиперпролактинемией. Гипрепролактинемия вызывает нарушения функции половых желез у мужчин и очень плохо влияет на сперматогенез и гормонпродуцирующую функцию яичек. Гиперпролактинемия - одна из ведущих причин бесплодия.Снижение уровня пролактина:
- Недостаточность гипофиза, апоплексии гипофиза
- Приема лекарственных препаратов (противосудорожных средств, морфина и др.).
Подготовка к исследованию:Анализ сдается утром, однако не ранее чем через 3 часа после пробуждения.За один день до исследования исключить половые отношения, не посещать сауну, не употреблять алкоголь, избегать стресса (или не сдавать анализ после перенесенного волнения), избегать воздействия на молочные железы. Не рекомендуется курить в течение часа перед исследованием и быть в состоянии покоя около 30 минут (отдохнуть и успокоиться) перед исследованием. Исследованию крови - строго натощак. Оценка гормонального резерва пролактина при гиперпролактинемии (проба с церукалом).Церукал является антагонистом дофамина центрального действия и стимулирует секрецию пролактина. Метоклопрамид (церукал) вводят внутривенно в дозе 10 мг, кровь для определения пролактина берут в следующие временные интервалы: 0, 15, 30, 60, 120 мин. Помимо внутривенного теста можно использовать прием 120 мг метоклопрамида внутрь с последующим определением пролактина через каждые 30 минут в течение 4 часов. В норме в ответ на введение метоклопрамида уровень пролактина в сыворотке крови увеличивается в 10-15 раз по сравнению с исходными цифрами. При пролактиноме содержание пролактина в ответ на метоклопрамид практически не изменяется, тогда, как при функциональной гиперпролактинемии отмечается дальнейшее повышение уровня пролактина по сравнению с исходными цифрами, но оно значительно ниже показателей, наблюдаемых в норме. Первичный врожденный гипогонадизм и нарушения половой дифференцировки. Первичный врожденный гипогонадизм неразрывно связан нарушениями процесса развития плода мужского пола. Эти нарушения разнообразны, но при этом, по той или иной причине, возникает симптомокомплекс первичного гипогонадизма.Половая дифференцировка - последовательный и упорядоченный процесс. Хромосомный пол, формирующийся в момент оплодотворения, определяет гонадный пол, а гонадный пол в свою очередь обусловливает развитие фенотипического пола, предполагающего образование мужского или женского мочеполового аппарата. Изменения на любом этапе этого процесса во время эмбриогенеза приводят к нарушениям половой дифференцировки. К известным причинам нарушения полового развития относятся изменения окружающей среды, несемейные аберрации половых хромосом, врожденные пороки развития многофакторного генеза, а также наследственные дефекты, обусловленные мутациями одиночных генов. Ограниченность знаний позволяет дать лишь эмпирическую оценку характеру физиологических нарушений при некоторых дефектах. На первом этапе половой дифференцировки устанавливается хромосомный пол: пол гетерогаметы (XY) - мужской, а гомогаметы (XX) - женский.Затем примерно до 40-го дня беременности эмбрионы обоего пола развиваются одинаково.Вторая стадия половой дифференцировки заключается в превращении недифференцированных гонад в яички или яичники. Дифференцировка гонад в яички опосредуется генами Y-хромосомы, один из которых либо идентичен гену, кодирующему HY-антиген, либо тесно сцеплен с ним. Завершающий процесс - трансляция гонадного пола в фенотипический пол - зависит от типа образовавшихся гонад плода и их эндокринной секреции. Развитие фенотипического пола приводит к формированию мужского и женского мочеполового аппарата.Внутренние половые органы образуются из вольфовых и мюллеровых протоков, которые на ранних стадиях эмбрионального развития обоих полов расположены рядом.У зародышей мужского пола вольфовы протоки дают начало придаткам яичка, ссмявыносящим протокам и семенным пузырькам, а мюллеровы протоки исчезают.У эмбрионов женского пола из мюллеровых протоков развиваются маточные трубы, матка и верхняя часть влагалища, а вольфовы протоки регрессируют.Наружные гениталии и уретра у плодов обоего пола развиваются из общей закладки - урогенитального синуса и полового бугорка, складок и вздутий.Урогенитальный синус у плода мужского пола дает начало предстательной железе и простатической части уретры, а у плода женского пола - уретре и части влагалища.Из полового бугорка образуется головка полового члена у плодов мужского пола и клитор у плодов женского пола. Урогенитальные вздутия превращаются в мошонку или большие половые губы, а половые складки - в малые половые губы или сливаются, образуя мужскую уретру и ствол полового члена.Если яички отсутствуют, как, например, у нормальных эмбрионов женского пола или у мужских зародышей, кастрированных до начала фенотипической дифференцировки, развитие фенотипического пола происходит по женскому направлению. Таким образом, маскулинизация плода - это положительный результат действия гормонов эмбриональных половых желез, тогда как развитие по женскому типу не требует присутствия гонад. Половой фенотип в норме соответствует хромосомному полу. Иными словами, хромосомный пол определяет гонадный пол, а гонадный пол в свою очередь контролирует фенотипический пол. Классификация первичного гипогонадизма и нарушений полового развития у мужчин. I. Нарушения хромосомного пола
- Синдром Клайнфелтера
- Синдром Ла Шапелля (мужчины с кариотипом XX)
- Синдром Шерешевского-Тернера (дисгенезия гонад)
- Смешанная дисгенезия гонад
- Истинный гермафродитизм
- Синдром ХYY
II. Нарушения гонадного пола
- Чистая дисгенезия гонад
- Синдром отсутствия яичек
- Синдром Нунан
III. Нарушения фенотипического полаЖенский псевдогермафродитизм
- Врожденная гиперплазия надпочечников
- Женский псевдогермафродитизм вненадпочечникового генеза
- Нарушения развития мюллеровых протоков
Мужской псевдогермафродитизм
- Нарушения синтеза андрогенов
- Нарушения действия андрогенов
- Синдром персистенции мюллеровых протоков
IV. Изолированные нарушения развития мужских гениталий и репродуктивной функции.V. Нарушения половой дифференцировки вследствие генных мутации аутосом или вследствие воздействия эмбриотоксических факторов. Нарушения хромосомного пола. Нарушения хромосомного пола возникают при изменении числа или строения Х - или Y-хромосом.Формирование мужского фенотипа обусловливается действием трех гормонов.Два из них: антимюллеровский гормон и тестостерон - это секреторные продукты эмбриональных яичек. Антимюллеровский гормон представляет собой белковый гормон, который вызывает обратное развитие мюллеровых протоков и, следовательно, предотвращает формирование матки и маточных труб у эмбрионов мужского пола. Тестостерон непосредственно стимулирует дифференцировку производных вольфовых протоков и служит предшественником третьего эмбрионального гормона - дигидротестостерона. Дигидротестостерон, который образуется из присутствующего в крови тестостерона, индуцирует формирование мужской уретры, предстательной железы, полового члена и мошонки. Таким образом, во время внутриутробной жизни тестостерон и дигидротестостерон вызывают образование акцессорных органов мужской репродуктивный системы, действуя через тот же внутриклеточный механизм, который опосредует их эффекты в дифференцированных тканях. Секреция тестостерона эмбриональными яичками достигает максимума к 8- 10-й неделе беременности, а формирование полового фенотипа завершается в основном к концу I триместра. На поздних стадиях беременности у плодов женского пола происходят развитие фолликулов в яичниках и созревание влагалища, а у плодов мужского пола - опущение яичек и рост наружных гениталий.Клинические проявления первичного гипогонадизма связанного с нарушениями хромосомного пола. 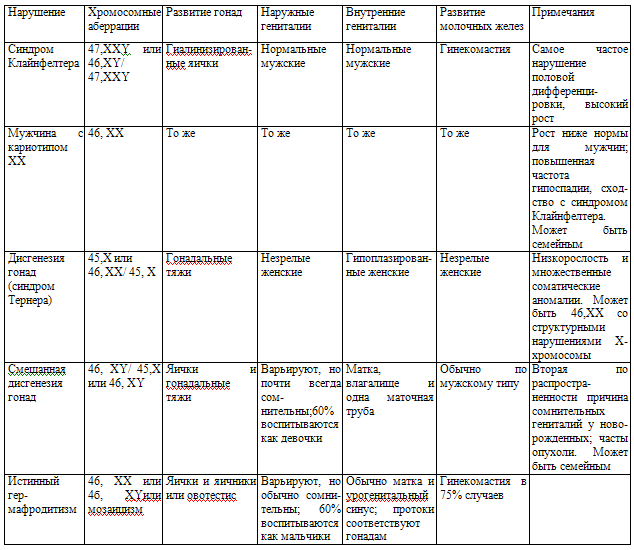

Синдром Клайнфелтера
Клинические проявления. Синдром Клайнфелтера характеризуется первичным гипогонадизмом (маленькие твердые яички), азооспермией, гинекомастией и повышенным уровнем гонадотропинов в плазме мужчин с двумя или более Х-хромосомами.
Существуют 2 основные формы синдрома Клайнфелтера:
- классический синдром - 47,ХХУ (встречается в 90% наблюдений);
- мозаичный синдром - 46,ХУ/47,ХХУ (выявляется примерно в 10%).
Этот синдром представляет собой самое распространенное нарушение половой дифференцировки и встречается с частотой примерно 1 случай на 500 мужчин.
В препубертатном возрасте у больных отмечают маленькие яички, но в остальном они выглядят нормально. Только задержка полового развития в пубертатном периоде и гипоплазия яичек проявляют синдром Клайнфелтера. После полового созревания болезнь проявляется бесплодием, гинекомастией или иногда андрогенной недостаточностью.
Постоянным признаком кариотипа 47, XXY является гиалинизация семенных канальцев и азооспермия. Яички небольшие, плотные, длиной менее 2см
Увеличение среднего роста определяется удлинением нижней части туловища. Гинекомастия появляется обычно в отрочестве и, как правило, с обеих сторон; молочные железы болезненны и могут увеличиваться до размеров, изменяющих фигуру. Риск возникновения рака молочных желез в 20 раз превышает таковой среди здоровых мужчин (но в 5 раз меньше такового у женщин).
От 30 до 50% больных страдают ожирением и варикозным расширением вен.
Часто встречаются легкая психическая отсталость, трудности в социальной адаптации, нарушения функции щитовидной железы, сахарный диабет и заболевания легких.
Для большинства больных характерна мужская психосексуальная ориентация, половая функция у них как у здоровых мужчин.
Вариантные формы синдрома Клайнфелтера.
Изучено около 30 кариотипов синдрома Клайнфелтера. Чем больше количество X-хромосом (XXXV, ХХХХУ), тем более выражена умственная отсталость. Нередко у этих больных наблюдается крипторхизм, различные костные нарушения (сращение проксимальных отделов лучевой и локтевой кости с разрастанием их головок, вогнутость мизинцев).
Мозаичная форма синдрома Клайнфелтера (46,ХУ/47,ХХУ).
Мозаичная форма протекает обычно не столь тяжело, как вариант 47, XXY, и яички могут сохранять нормальные размеры. Эндокринные нарушения также выражены слабее, а гинекомастия и азооспермия встречаются реже. Больше того, больные с мозаицизмом иногда могут сохранять фертильность. У некоторых из них из-за незначительности физических отклонений от нормы можно и не заподозрить правильного диагноза.
Иногда единственным симптомом является психическая отсталость.
Для подтверждения синдрома Клайнфелтера требуется доказать наличие дополнительной Х-хромосомы в каких-либо тканях. При анализе кожи, слизистой оболочки щеки или периферической крови может обнаруживаться нормальный набор хромосом, но если клетки яичка содержат несколько Х-хромосом, то развивается тестикулярная дисгенезия, характерная для синдрома Клайнфелтера.
Содержание фолликулостимулирующего (ФСГ) и лютеинизирующего гормона (ЛГ) в плазме обычно повышен. Из-за постоянного дефекта семенных канальцев уровень ФСГ меньше перекрывается нормальными показателями и имеет большее диагностическое значение. Уровень тестостерона в плазме в среднем составляет половину нормального, но его колебания перекрываются нормальными. Среднее содержание эстрадиола в плазме по не совсем ясным причинам повышено.
В результате, как на ранних, так и на поздних стадиях проявляется та или иная степень недостаточной андрогенизации и избыточной феминизации. Феминизация, включая гинекомастию, зависит от относительного или абсолютного преобладания эстрогенов над андрогенами в крови, и у лиц с меньшим содержанием тестостерона и большим содержанием эстрадиола возрастает вероятность развития гинекомастии.
У больных с нелеченым синдромом Клайнфелтера может иметь место «реактивная патология гипофиза» в виде увеличения или деформации турецкого седла.
Восстановить фертильность при синдроме Клайнфелтера невозможно, а единственным эффективным способом коррекции гинекомастии является хирургическое удаление ткани молочных желез. Некоторым больным с недостаточной андрогенизцией помогает терапия андрогенами, но иногда она приводит к парадоксальному усилению гинекомастии
46, ХХ-мужчины (Синдром Ла Шапелля)
Кариотип 46, XX у фенотипических мужчин встречается с частотой приблизительно 1:20000 - 1:24000. Встречается в 10 раз реже, чем синдром Клайнфельтера.
У таких лиц все женские внутренние гениталии отсутствуют, и в психосексуальном плане они ощущают себя мужчинами. Действительно, признаки этого синдрома сходны с таковыми при синдроме Клайнфелтера: яички маленькие и плотные (обычно меньше 2см), часто наблюдается гинекомастия, азооспермия и гиалинизация семенных канальцев, половой член либо нормальных, либо уменьшенных размеров. Концентрация тестостерона в плазме понижена, эстрадиола повышена, а содержание гонадотропинов достигает высокого уровня. Такие больные отличаются от больных с классическим синдромом Клайнфелтера только тем, что их рост в среднем ниже, чем у нормальных мужчин, психическое отставание встречается не чаще, чем в общей популяции, и увеличена частота гипоспадии.
Патогенез этого нарушения объясняют следующим образом:
- транслокацией части Y-хромосомы на Х-хромосому; длинное плечо хромосомы Y в таких случаях утрачивается, отсутствует и локус AZF, что объясняет азооспермию.
- мозаицизмом по Y-хромосоме в некоторых клеточных линиях или ранней потерей Y-хромосомы;
- мутацией аутосомного гена
- делецией генетического вещества Х-хромосомы, в норме оказывающего отрицательный регуляторный эффект на развитие яичек.
Однако ни одна из них не в состоянии полностью объяснить данное нарушение. Мозаицизм в большинстве случаев вряд ли имеет место, но все остальные процессы вполне возможны. Нельзя исключить и гетерогенную природу синдрома. Терапевтические мероприятия в таких случаях аналогичны таковым при синдроме Клайнфелтера.
Дисгенезия гонад (Синдром Шерешевского-Тернера)
Синдрому Шерешевского-Тернера (дисгенезии гонад), как никакому другому, свойственны различные формы хромосомных аномалий по половым хромосомам - делеции, изохромосомы, кольцевые хромосомы, разнообразный мозаицизм.
Частота дисгенезии гонад - 1:2500 новорожденных девочек.
Простая полная моносомия (45,X) наблюдается примерно у половины больных женщин, тогда как у остальных - различные варианты хромосомных аномалий. Мужчины с мозаицизмом 45Х/46ХY составляют примерно 5% от общего количества больных с синдромом Шерешевского-Тернера. Такая форма синдрома характеризуется широким диапазоном клинических проявлений в зависимости от соотношения клеточных клонов - от типичного синдрома Шерешевского-Тернера - до нормального мужского фенотипа.
Основные признаки дисгенезии гонад:
- Низкорослость
- Дисгегнезия или полное отсутствие яичек (на их месте находят недифференцированные тяжевидные зачатки).
Низкорослость и другие соматические изменения являются следствием потери генетического материала с короткого плеча Х-хромосомы. Гонадальные тяжи образуются при потере генетического материала либо с длинного, либо с короткого плеча Х-хромосомы. У больных с мозаицизмом или структурными нарушениями Х-хромосомы изменения фенотипа занимают по тяжести промежуточное положение между теми, которые наблюдаются при варианте 45,Х, и нормой.
Другие признаки дисгенезии гонад:
- короткая шея с крыловидными складками;
- характерное «старушечье» лицо;
- оттопыренные, низко расположенные уши;
- низкая линия роста волос на затылке;
- широко расставленные недоразвитые соски;
- непропорционально маленькие ноги;
- множественные пигментные невусы.
Внешний вид пациентов очень похож на вид пациентов при синдроме Нунан.
Однако при синдроме Шерешевского-Тернера имеются отличительные от синдрома Нунан клинические особенности:
- у новорожденных и детей грудного возраста наблюдается лимфатический отек стоп, голеней, кистей рук и предплечий;
- вальгусная деформация поражает как локтевые, так и коленные суставы;
- остеопороз;
- бочкообразная грудная клетка;
- низкий рост волос на шее;
- высокое небо;
- изменение ногтей на стопах и кистях.
Синдром Шерешевского-Тернера следует отличать также:
- от смешанной дисгенезии гонад, при которой с одной стороны имеется яичко, а с другой - гонадальный тяж;
- от чистой дисгенезии гонад: в этом случае гонадальные тяжи с обеих сторон имеют место у лиц с нормальным кариотипом 46, XX или 46, XY, нормальным ростом и первичной аменореей;
Уровни лютеинизирующего и фолликулостимулирующего гормонов повышены в первые 3-4 года жизни, к 5-8 годам они снижаются до возрастной нормы, а позже вновь возрастают - сначала фолликулостимулирующий, затем лютеинизирующий гормоны.
У больных с мозаицизмом 45,X/46,XY в зачатках половых желез может присутствовать гормонально-активная ткань яичек, поэтому повышен риск гонадобластомы. В таких случаях зачатки половых желез надо удалять. Удаление половых желез показано также больным, у которых при цитогенетическом исследовании Y-хромосома не выявлена, но при молекулярно-генетическом исследовании обнаружен ген SRY, кодирующий фактор развития яичка.
Смешанная дисгенезия гонад
Смешанная дисгенезия гонад - это состояние, при котором у фенотипических мужчин или женщин с одной стороны имеется яичко, а с другой - гонадальный тяж.
У большинства больных обнаруживается мозаицизм 45, Х/46,XY.
Частота синдрома неизвестна, но, по данным большинства клиник, это вторая по частоте (после врожденной гиперплазии надпочечников) причина амбисексуальности гениталий у новорожденных. Примерно 60% больных считают девочками, а большинство фенотипических мальчиков при рождении не полностью вирилизированы.
У большинства обнаруживают амбисексуальные гениталии, включая несколько увеличенный половой член, урогенитальный синус и в различной степени сращенные в мошонку половые губы. Яичко у большинства больных расположено интраабдоминально; лиц с яичком в паху или в мошонке считают мальчиками. Почти всегда есть матка, влагалище и, по крайней мере, одна маточная труба.
До пубертатного возраста яичко кажется относительно нормальным. В постпубертатном возрасте оно содержит множество зрелых клеток Лейдига, но семенные канальцы лишены зародышевых элементов и содержат лишь клетки Сертоли. Гонадальный тяж - тонкое бледное удлиненное образование, расположенное либо в широкой связке, либо на тазовой стенке, состоит из стромы яичника. У больных пубертатного возраста яичко секретирует андрогены и происходит как вирилизация, так и увеличение размеров полового члена. Феминизация встречается редко, но при ее наличии следует заподозрить секрецию эстрогенов опухолью гонад.
Примерно у 30% больных отмечают соматические проявления 45, Х-дисгенезии гонад - низкую заднюю линию оволосения, щитообразную грудную клетку, множественные пигментированные родимые пятна, вальгусную деформацию предплечий, складчатость шеи и рост менее 150см.
Практически все больные хроматинотрицательны. При обследовании группы больных у 60% был обнаружен кариотип 45, X/46.XY, у остальных - кариотип 46, XY, но частота мозаицизма могла быть заниженной или ограниченной лишь некоторыми линиями клеток. Причину мозаицизма 45, Х/46,XY лучше всего объясняет утрата Y-хромосомы на ранних стадиях митотического деления XY-зиготы.
Предполагается, что 46, XY-клеточная линия стимулирует дифференцировку яичка, тогда как 45, Х-линия обусловливает развитие контралатерального гонадального тяжа. Но как маскулинизация, так и регрессия мюллеровых протоков осуществляется не полностью. Возможно, что яичко плода просто не способно синтезировать нужное количество антимюллеровского гормона и андрогенов.
Следует отметить, что у детей старшего возраста и взрослых лиц, у которых пол зафиксирован до установления диагноза, возможно появление в гонадах опухоли. Общая частота таких опухолей составляет 25%. Семиномы встречаются чаще, чем гонадобластомы, причем опухоли могут возникать и до полового созревания. Этому чаще подвержены больные с женским фенотипом, лишенные соматических признаков типичной 45,Х-дисгенезии гонад, интраабдоминальные яички поражаются чаще, чем гонадальные тяжи. Когда у больных с женским фенотипом диагноз установлен, следует провести эксплоративную лапаротомию и профилактическую гонадэктомию, как потому, что опухоли гонад могут развиваться в детстве, так и потому, что яичко в пубертате секретирует андрогены и вызывает тем самым вирилизацию. С целью индуцировать и поддерживать феминизацию таким больным, как и лицам с дисгенезией гонад, затем назначают эстрогены.
Лечение больных с мужским фенотипом, у которых диагноз установлен в старшем детском возрасте или в зрелые годы, затруднено. Фенотипические мужчины со смешанной дисгенезией гонад бесплодны (в яичках отсутствуют зародышевые элементы), и у них также повышен риск появления опухолей гонад.
В каких же случаях можно без опасений сохранять яичко? Как правило, нужно учитывать следующее: опухоли развиваются в мошоночных гонадальных тяжах, но не в расположенных в мошонке яичках; опухоли, появляющиеся в неопущенных яичках, всегда связаны со структурами ипсилатерального мюллерова протока; опухоли в гонадальных тяжах всегда связаны с опухолями в контралатеральных интраабдоминальных яичках. Поэтому рекомендуется удалять все гонадальные тяжи, сохранять яички, находящиеся в мошонке, и удалять интраабдоминальные яички, кроме тех случаев, когда их удается низвести в мошонку, и когда они не связаны со структурами ипсилатерального мюллерова протока. При проведении реконструктивных операций на половом члене необходимо учитывать характер дефекта.
Если диагноз установлен в раннем детстве и гениталии амбисексуальны, чаще выбирают женский пол. Позднее можно произвести резекцию увеличенного полового члена и гонадэктомию (обычно сразу). Если же выбирают мужской пол, то при решении вопроса об удалении яичка я детстве пользуются теми же критериями, что и у взрослых мужчин.
Истинный гермафродитизм
Истинный гермафродитизм - это состояние, при котором у больного есть и яичники и яички или гонады с гистологическими особенностями того и другого пола (овотестис). Подтвердить диагноз можно лишь в том случае, если при гистологическом исследовании обнаружен гонадный эпителий обоих типов (обнаружить только строму яичника без ооцитов недостаточно).
Частота встречаемости синдрома неизвестна, но в литературе описано более 400 случаев. Больных подразделяют на три группы:
- у 20% с обеих сторон присутствует и тестикулярная, и яичниковая ткань (овотестис);
- у 40% на одной стороне имеется овотестис, а на другой - либо яичник, либо яичко;
- у остальных на одной стороне присутствует яичко, а на другой - яичник.
Наружные половые органы у больных находятся на различных стадиях перехода от мужских к женским. Две трети достаточно маскулинизированных больных (их около 60%) воспитывают как мальчиков. Однако нормальные мужские наружные половые органы имеют меньше 10% больных; у большинства отмечают гипоспадию и более чем у 50%- неполное сращение половых губ в мошонку. У 60% лиц с женским фенотипом увеличен клитор, и у большинства имеется урогенитальный синус. Дифференцировка внутренних протоков обычно соответствует прилежащей гонаде. Хотя у яичка обычно развит придаток, семявыносящий проток полностью формируется лишь у 30% больных. Среди лиц с овотестис у 75% имеется придаток яичка, у 60% - маточная труба. Матка обычно гипоплазирована или имеет один рог. Яичники, как правило, занимают нормальное положение, но яички или овотестис могут обнаруживаться на любом уровне вдоль пути опущения яичка в эмбриогенезе и часто сочетаются с паховой грыжей. У 30% больных тестикулярная ткань локализуется в мошонке или губномошоночной складке, у 30% - в паховом канале, у остальных - в полости живота.
Период полового созревания характеризуется феминизацией и вирилизацией той или иной степени; у 75% больных появляется гинекомастия и примерно у 50% - менструации. У лиц с мужским фенотипом менструации проявляются в виде циклической гематурии. Овуляция происходит примерно у 25% больных - чаще, чем сперматогенез. У лиц с мужским фенотипом овуляция может проявляться болями в яичках. Описаны фертильные индивиды с женским фенотипом, у которых были удалены овотестис, а также «мужчина», имевший двоих детей. Врожденные дефекты других систем встречаются редко.
Примерно у 60% больных кариотип 46, XX, у 10% - 46, XY, а у остальных - хромосомный мозаицизм, при котором присутствует клеточная линия с Y-хромосомой. Механизм, определяющий такое развитие гонад, неизвестен. Полагают (хотя это и не доказано имеющимися методами кариотипирования), что в данном случае присутствует достаточное количество генетического материала Y-хромосомы (вследствие транслокации, нерасхождения или мутации), чтобы индуцировать развитие тестикулярной ткани. В редких случаях поражаются многие сибсы с кариотипом 46, XX, что обусловлено, вероятно, присутствием аутосомно-рецессивного гена или общей транслокацией.
Поскольку в яичниках более 25% больных содержатся желтые тела, можно заключить, что у таких индивидов нормально функционирует женская нейроэндокринная система. Феминизация (гинекомастия и менструации) обусловлена секрецией эстрадиола имеющейся яичниковой тканью. У маскулинизированных индивидов секреция андрогенов преобладает над секрецией эстрогенов, и у некоторых из них вырабатываются сперматозоиды.
Если диагноз установлен у новорожденного или ребенка младшего возраста, выбор пола зависит от анатомических признаков. У детей старшего возраста и у взрослых следует удалять гонады и их внутренние протоки, противоречащие преобладающему фенотипу и полу воспитания, и в необходимых случаях соответственно изменять наружные половые органы. Хотя при истинном гермафродитизме опухоли гонад встречаются редко, у лиц с XY-клеточной линией диагностировали гонадобластомы. Поэтому при решении вопроса о сохранении ткани гонад надо учитывать возможность появления в них опухоли.
Синдром ХYY
Кариотип 47,XYY; частота 1 на 1000 новорожденных. За последние четверть века полисомия хромосомы Y обнаружена у нескольких десятков мужчин. Характерными признаками этой хромосомной патологии являются асоциальное поведение и различные психологические нарушения, имеющиеся у 35% больных; среди мужчин с различными психическими отклонениями и асоциальным поведением частота синдрома колеблется от 0,45 до 15%. Более чем у 30% пациентов с кариотипом 47,ХYY наблюдается нарушение репродуктивной функции. Клеточная линия 47,XYY в кариотипе больных с анеуплодией хромосомы Y иногда сочетается с клонами 45X, 46XY, 47XXY, 48XXYY. Описаны случаи мозаицизма 45X/49XYYYY и 47XYY/48XYYY/49XYYYY у пациентов с психическими отклонениями и нарушением репродуктивной функции. Описано несколько случаев обнаружения кариотипа 48,XYYY, из которых в половине выявлен мозаицизм с присутствием нормальной клеточной линии 46,XY. У таких больных отмечаются неонатальная асфиксия, умственная отсталость, ожирение. Часто они являются пациентами психиатрических клиник, для них характерны транссексуальность, агрессивность и периоды депрессии. Азооспермия у этих пациентов обусловлена атрофией семенных канальцев и полным отсутствием сперматогенеза.
Нарушения гонадного пола
О нарушении гонадного пола говорят в том случае, когда дифференцировка гонад не соответствует хромосомному полу, т. е. хромосомный пол не соответствует гонадному и фенотипическому полу.
Чистая дисгенезия гонад (Синдром Свайера).
«Чистая» дисгенезия гонад, или синдром Свайера, дисгенезия гонад при 46,XY, описана G.I.M. Swyer в 1955 г. как случай мужского псевдогермафродитизма.
Чистая дисгенезия гонад - это нарушение, при котором индивиды обладают женским фенотипом и половые органы у них, в том числе гонады, идентичны таковым у лиц с дисгенезией гонад - двусторонние гонадальные тяжи, инфантильные матка и маточные трубы и половой инфантилизм. Имеет место нормальный рост, нормальный кариотип
46, XX или 46, XY, при этом у них практически отсутствуют врожденные аномалии (отсюда слово «чистая» в названии синдрома). Эта аномалия встречается в 10 раз реже, чем дисгенезия гонад.
С генетической точки зрения, оно отлично от дисгенезии гонад, но дифференцировать чистую дисгенезию гонад от дисгенезии гонад с минимальными соматическими аномалиями по клиническим признакам невозможно.
Молекулярно-генетические исследования показывают, что в таких случаях имеется делеция на коротком плече Y хромосомы (Yp) или имеется 46Yxp как результат транслокации фрагмента ХР на нормальную Y хромосому. Лишь у небольшого числа больных с данной патологией выявляется делеция короткого плеча Y хромосомы, где локализуется ген SRY (ген, определяющий развитие яичек).
Больные, как правило, высокого роста (иногда более 170см). Дефицит эстрогенов варьирует от резко выраженного, характерного для типичной 45, Х-дисгенезии гонад, до незначительного. В последнем случае у больных до некоторой степени развиты молочные железы, бывают менструации, хотя менопауза наступает довольно рано. Примерно у 40% больных отмечают определенной степени феминизацию. Подмышечное и лобковое оволосение скудное, а внутренние половые органы представлены лишь производными мюллеровых протоков. В гонадальных тяжах могут развиваться опухоли, особенно дисгерминомы или гонадобластомы (при кариотипе 46, XY). Такие опухоли часто сопровождаются признаками вирилизации или появлением плюс - ткани в области таза.
Лечение больных с дефицитом эстрогенов аналогично таковому при дисгенезии гонад. Заместительную терапию эстрогенами начинают в срок ожидаемого полового созревания и продолжают на протяжении всего периода зрелости.
Больным с кариотипом 46, XY после установления диагноза следует провести эксплоративную операцию и удалить гонадальные тяжи в связи с высокой частотой появления у них опухолей гонад. Показанием к немедленной операции служит проявление признаков вирилизации. Естественное развитие опухолей гонад при данном синдроме остается неясным, но прогноз после их хирургического удаления обычно благоприятный.
Синдром отсутствия тестикул (анорхия, тестикулярная регрессия, агенезия гонад, агонадизм)
Самая чистая форма этого заболевания - это индивиды с женским фенотипом и кариотипом 46, XY. У них нет яичек, выражен половой инфантилизм и отсутствуют как производные мюллеровых протоков, так и акцессорные органы мужской репродуктивной системы. Такие больные отличаются от лиц с 46, XY-формой чистой дисгенезии гонад тем, что у них не удается обнаружить никаких остатков гонад: ни гонадальных тяжей, ни производных мюллеровых протоков. Тестикулярная недостаточность должна возникать на этапе между началом образования антимюллеровского гормона, и секрецией тестостерона, т. е. уже после развития семенных канальцев, но перед началом функционирования клеток Лейдига.
У лиц с более значительной вирилизацией наружные половые органы имеют мужской фенотип при полном отсутствии или наличием рудиментарных яичек (с отсутствием придатков яичек, семявыносящих протоков, предстательной железы). При рождении у ребенка значительно уменьшенный в размерах половой член, с недоразвитием пещеристых тел и уменьшенной головкой, мошонка недоразвита или может отсутствовать вовсе. При пальпации мошонки яички найти не удается. Анорхизм необходимо отличать от более часто встречающегося брюшного двустороннего крипторхизма.
В подростковом периоде во время полового созревания формируется «евнухоидный» тип скелета с длинными конечностями, отсутствием или снижением оволосения по мужскому типу, гинекомастией (увеличение молочных желез). Обычно это состояние сопровождается повышением массы тела. Психосексуальная ориентация ослаблена вплоть до интерсексуальности.
Патогенез болезни неясен. Регрессия яичек могла бы определяться мутантным геном, тератогеном или травмой. Предполагается роль влияния тяжёлых инфекционных заболеваний, интоксикаций, нерационального питания беременной, а также различного рода гормональных сдвигах в организме во время беременности.
Лиц с половым инфантилизмом и женским фенотипом следует лечить так же, как больных с дисгенезией гонад, т. с. им необходимо вводить эстрогены в количестве, способном вызвать развитие молочных желез и характерные для женщины соматических изменения. В случае любых проявлений сопутствующей агенезии влагалища показаны хирургические или консервативные методы.
Подобно этому, лицам с мужским фенотипом и анорхией следует вводить андрогены в количестве, которое могло бы обеспечить развитие нормальных мужских вторичных половых признаков. Больным с неполной вирилизацией или амбисексуальным развитием наружных половых органов требуется индивидуальный подход к решению вопроса о необходимости хирургического лечения, помимо гормонального лечения в срок ожидаемого полового созревания.
Синдром Нунан
Синдром Нунан встречается у 1 из 8000 новорожденных (у 1 из 16000 мальчиков) у лиц с нормальным набором хромосом (46,ХY). Наследование аутосомно-доминантное. Клинические проявления при синдроме Нунан подобны таковым при синдроме Шерешевского-Тернера (45,X). Это привело к тому, что в течение длительного времени для пациентов с синдромом Нунан формально использовался термин "мужской синдром Тернера". Оказалось, что при синдроме Нунан генетический дефект локализован в длинном плече 12-й хромосомы, и заболевание поражает как мужчин, так и женщин, поэтому для этих пациентов нельзя использовать термин "мужской синдром Тернера".
Патогномоничных симптомов синдрома Нунан нет. Диагноз устанавливается на основании совокупности всех выявленных клинических проявлений:
- гипоплазия яичек;
- крипторхизм;
- низкорослость при правильных пропорциях тела;
- масса тела часто ниже третьего перцентиля;
- задержка полового развития;
- "нунан-типичное" лицо (птоз, широкий нос, широко расставленные глаза, антимонголоиодный разрез глазных щелей, низко посаженные уши);
- короткая и широкая шея со складками;
- вальгусная деформация локтевых суставов;
- плоская грудная клетка;
- сердечно-сосудистые аномалии (стеноз легочной артерии, гипертрофия вентрикулярной перегородки), выявляемые у 80% больных при электрокардиографии.
Уровень ФСГ и Л Г, как правило, в пределах нормы. Концентрация тестостерона нормальная или снижена.
Лечение симптоматическое. Низведение яичек не приводит к улучшению сперматогенеза.
Нарушения фенотипического пола
Классификация.
Женский псевдогермафродитизм
- Врожденная гиперплазия надпочечников (адреногенитальный синдром).
- Женский псевдогермафродитизм вненадпочечниковою генеза.
- Врожденные дефекты мюллеровых протоков (синдром Майера - Рокитанского - Кюстера - Хаузера).
Мужской псевдогермафродитизм
1. Нарушения синтеза андрогенов.
- Нарушение синтеза андрогенов вследствие ферментных дефектов стероидогенеза.
- Нарушение синтеза андрогенов вследствие аплазии клеток Лейдига при генетических мутациях лютеинизирующего гормона или рецептора лютеинизирующего гормона.
2. Нарушения действия андрогенов.
- Недостаточность 5a-редуктазы.
- Патология рецепторов андрогенов.
•1. Синдром тестикулярной феминизации.
•2. Синдром Рейфенштейна.
- 3. Синдром мужского бесплодия при патологии андрогенных рецепторов.
- Резистентность при наличии рецепторов.
3. Синдром персистенции мюллеровых протоков.
Женский псевдогермафродитизм
Врожденная гиперплазия надпочечников (адреногенитальный синдром).
Пути образования глюкокортикоидов в надпочечниках и андрогенов в яичках и надпочечниках показаны на рисунке.
Три фермента принимают участие в синтезе как глюкокортикоидов, так и андрогенов:
- 20,22-десмолаза
- 3b-гидроксистероид-дегидрогеназан
- 17a-гидроксилаза
Недостаточность любого из них препятствует образованию глюкокортикоидов и андрогенов и, следовательно, приводит как к врожденной гиперплазии надпочечников вследствие повышения уровня АКТГ, так и к недостаточной вирилизации эмбриона мужского пола - мужской псевдогермафродитизм.
В синтезе андрогенов участвуют два фермента:
- 17,20-десмолаза
- 17b-гидроксистероид-дегидрогеназа
Недостаток какого-либо из них приводит к чистому мужскому гермафродитизму при нормальном синтезе глюкокортикоидов.
Два фермента синтеза глюкокортикоидов нарушают образование гидрокортизона:
- 21-гидроксилаза
- 11b-гидроксилаза
Компенсаторно возрастающая секреция АКТГ вызывает гиперплазию надпочечников и вторичное усиление выработки андрогенов, что приводит к вирилизации у женщин и преждевременной маскулинизации у мужчин.
Основные особенности разных форм врожденной гиперплазии надпочечников перечислены в таблице.
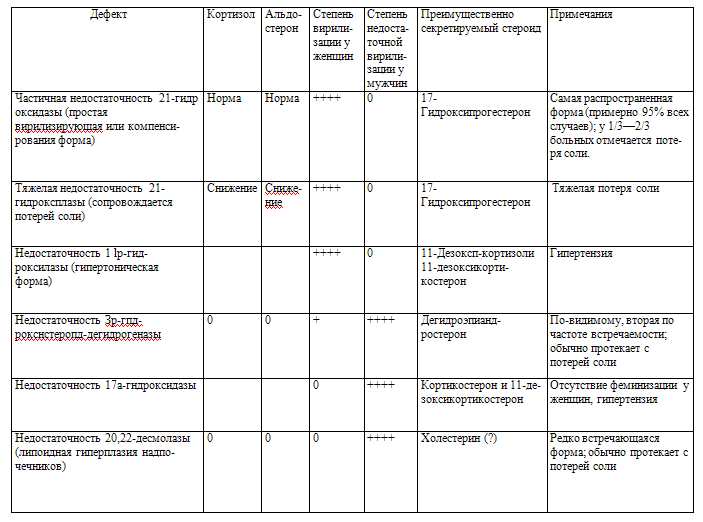
Недостаточность 21-гидроксилазы.
Чаще всего причиной амбисексуальности половых органов у новорожденных служит врожденная гиперплазия надпочечников вследствие недостаточности 21-гидроксилазы.
В Европе она встречается с частотой 1:5000, а в США - 1:15 000.
Вирилизация у девочек проявляется обычно уже при рождении, а у мальчиков - в первые 2-3 года жизни. Для девочек характерны гипертрофия клитора в сочетании с его вентральным подтягиванием (патологическая эрекция), частичное сращение лабиоскотальных складок и вирилизация уретры различной степени. Внутренние женские половые органы и яичники остаются интактными, а вольфовы протоки регрессируют нормально, вероятно, потому, что надпочечники начинают функционировать на относительно поздних этапах эмбриогенеза. Наружные половые органы у девочек сходны с таковыми у мальчиков с двусторонним крипторхизмом и гипоспадией. Лабиоскротальные складки увеличены и морщинисты и напоминают мошонку. В редких случаях вирилизация достигает такой степени, что у девочки полностью развивается мужская уретра, половой член, а также предстательная железа, что приводит к ошибке при определении пола новорожденных. Без лечения больные девочки в течение первого года жизни быстро растут и вирилизация у них прогрессирует. В период ожидаемого пубертата нормального полового созревания по женскому типу не происходит и менструации не появляются. Быстрое соматическое созревание у лиц обоего пола приводит к преждевременному заращению эпифизарных щелей и низкорослости в зрелые годы.
Так как дифференцировка мужского фенотипа остается нормальной, заболевание у мальчиков при рождении обычно не распознается, если только нет явной недостаточности надпочечников. Однако уже в первые годы жизни у больных наблюдают интенсивный рост и созревание наружных половых органов, частые эрекции и чрезмерное развитие мышц. Вирилизация у мальчиков может проявляться двояко. Избыточная секреция андрогенов надпочечниками ингибирует продукцию гонадотропинов, так что яички остаются незрелыми, несмотря на ускорение маскулинизации. В зрелые годы такие больные, если их не лечить, способны к эрекции и эякуляции, но сперматогенез у них отсутствует. В других случаях секреция андрогенов надпочечниками может активировать преждевременное созревание гипоталамо-гипофизарной оси и инициировать истинное преждевременное половое созревание, включая и сперматогенез. Без лечения у мужчин могут появляться АКТГ-зависимые «опухоли» яичек, состоящие из остатков клеток надпочечников.
Недостаточность 11b-гидроксилазы
Женский псевдогермафродитизм может быть вызван и недостатком 11b-гидроксилазы. В этом случае блокада гидроксилирования 11-го углеродного атома приводит к накоплению 11-дезоксикортизола и дезоксикортикостерона - сильного сользадерживающего гормона, что сопровождается не потерей соли, а гипертензией. Клинические проявления, обусловливаемые дефицитом глюкокортикоидов и избытком андрогенов, сходны с таковыми при недостаточности 21-гидроксилазы.
Недостаточность 21-гидроксилазы и 11b-гидроксилазы - следствие аутосомно-рецессивной мутации. Идентифицировано не менее трех форм недостаточности 21-гидроксилазы и все они связаны с мутациями генов, расположенных на 6-й хромосоме вблизи от локуса HLA-B. При недостаточности 11b-гидрокснлазы связь мутации с системой HLA остается неизвестной.
Эндокринная патология при этом состоянии сводится к повышению экскреции кетостероидов, как и основных метаболитов, накапливающихся выше места ферментной блокады. У нелеченных больных повышено содержание АКТГ в плазме. При недостаточности 21-гидроксилазы в крови накапливается 17-гидроксипрогестерон, выводимый с мочой преимущественно в виде прегнантриола. При недостаточности 11-гидроксилазы в крови накапливается 11-дезокснкортизол, который выводится с мочой преимущественно в виде тетрагидрокортиксолона.
Выбор пола должен определяться хромосомным и гонадным полом, и соответствующую хирургическую коррекцию наружных половых органов следует производить как можно в более ранние сроки. Это весьма важно, так как при правильном лечении мужчины и женщины могут стать фертильными. Однако если правильный диагноз устанавливается поздно (в возрасте старше 3 лет), выбор пола следует производить лишь после тщательного учета психосексуалыюй ориентации.
Консервативное лечение глюкокортикоидами предотвращает проявления недостаточности гидрокортизона, останавливает быструю вирилизацию и препятствует преждевременному соматическому развитию и заращению эпифизов. При недостаточности 11b-гидроксилазы подавление патологической секреции стероидов приводит к нормализации артериального давления, а при обоих вариантах обеспечивает своевременное начало менструальной функции и развитие женских вторичных половых признаков.
У мужчин терапия глюкокортикоидами подавляет секрецию андрогенов надпочечниками и приводит к нормализации секреции гонадотропинов, развитию яичек и сперматогенезу. Контролируют заместительную терапию, определяя содержание в плазме 17-гидропрогестерона, андростендиона, АКТГ и ренина.
Женский псевдогермафродитизм вненадпочечниковою генеза.
Женский псевдогермафродитизм редко имеет вненадпочечниковые причины. В прошлом введение беременным женщинам для профилактики аборта прогестинов, обладающих побочными андрогенными эффектами, приводило к маскулинизации плодов женского пола. Женский псевдогермафродитизм может встречаться также у детей, рожденных матерями с вирилизирующими опухолями (например, адренобластомами или лютеомами беременных); в редких случаях причину заболевания установить не удается.
Врожденные дефекты мюллеровых протоков (синдром Майера - Рокитанского - Кюстера - Хаузера).
Врожденная гипоплазия, или отсутствие влагалища, в сочетании с аномалией или отсутствием матки в качестве причины первичной аменореи уступает только дисгенезии гонад. У большинства больных нарушение диагностируют в возрасте ожидаемого полового созревания в связи с отсутствием менструаций. Рост и психическое развитие у них нормальны, а молочные железы, подмышечное и лобковое оволосение, а также телосложение соответствуют женскому типу.
Мужской псевдогермафродитизм
Нарушение вирилизации эмбриона мужского пола (мужской псевдогермафродитизм) может быть следствием нарушения синтеза андрогенов или их действия, аномалий регрессии мюллеровых протоков и каких-то неясных причин. В 80% случаев мужского псевдогермафродитизма синтез андрогенов у больных остается нормальным.
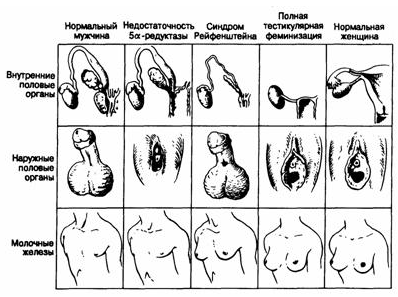
1. Нарушения синтеза андрогенов.
Нарушение синтеза андрогенов вследствие ферментных дефектов стероидогенеза.
Все пациенты с нарушением дифференцировки пола вследствие дефектов ферментов биосинтеза тестостерона имеют генотип 46,XY.
Тестостерон образуется из холестерина, при этом длина молекулярной цепи холестерина постепенно укорачивается. Первым этапом синтеза тестостерона является ферментация холестерина в прегненолон. Этот процесс происходит под действием фермента 20,22-десмолазы. Прегненолон, в свою очередь, под действием З р-гидроксистероид-дегидрогеназы трансформируется в прогестерон (Д4-путь) и в 17-окси-прегненолон (Л5-путь). Затем, полученные стероиды подвергаются ряду трансформаций под влиянием ферментов 17а-гидроксилазы, 17,20-десмолазы и 17р-гидроксистероид-дегидрогеназы. Образованный в результате многократной ферментации тестостерон поступает в кровеносное русло. Таким образом, трансформация холестерина в тестостерон происходит последовательно под влиянием пяти различных ферментных систем. Нарушение трансформации на любом этапе приводит к андрогенной недостаточности и к нарушению биохимических процессов и в других органах, которые регулируется подобными ферментными системами. Так, недостаточность 20,22-десмолазы может приводить к дефициту синтеза гемоглобина.
Известно несколько форм ферментной недостаточности.
- Недостаточность холестерин - десмолазы. Характерна тяжёлая форма потери соли. Выраженный дефицит минералокортикоидов и глюкокортикоидов, а также андрогенов приводит к смерти в раннем детском возрасте, несмотря на заместительную терапию стероидными гормонами
- Недостаточность Зр-гидроксистероид-дегидрогеназы. Мужчины вирилизированы неполностью (дефект синтеза тестостерона). Диагноз основывается на выявлении повышенных концентраций в крови дегидроэпиандростерона и 17-гидро-ксипрегненолона
- Недостаточность 17а-гидроксилазы
- Недостаточность 17-оксидоредуктазы предупреждает превращение андростендиона в тестостерон. Диагноз может быть установлен при обнаружении повышенного отношения андростендиона к тестостерону после стимуляции хорионическим гонадотропином.
- Недостаточность 17-а-кетостероид редуктазы яичек
- Недостаточность 17,20-десмолазы - редкая причина мужского псевдогермафродитизма, возникающего в результате блока превращения прогестагенов в андрогены. Дефект может быть выявлен по искажённому соотношению прогестагенов и андрогенов как на базальном уровне, так и после стимуляции хорионическим гонадотропином.
Клинические проявления недостаточности ферментных систем синтеза тестостерона подвержены значительной вариабельности - от незначительной гипоспадии ("гипоспадия без гипоспадии") - до мужского псевдогермафродитизма, когда наружные половые органы у мальчика развиваются по женскому типу. Кроме того, недостаточность синтеза тестостерона приводит к недоразвитию андрогенозависимых органов: имеются яички, но маскулинизация неполная. Имеет место гипоспадия, микрофаллия, недоразвитая мошонка с яичками или без них.
Диагностическое значение у пациентов с частичной недостаточностью ферментов синтеза тестостерона и низким уровнем тестостерона в плазме крови имеет проба с хорионическим гонадотропином. Если после стимуляции хорионическим гонадотропном происходит увеличение концентрации Д4-андростендиона, а уровень тестостерона не изменяется, то это свидетельствует о недостаточности фермента 17р-гидроксистероид-дегидрогеназы, под влиянием которого в норме и происходит ферментация андростендиона в тестостерон.
При нарушениях, сопровождающихся гипоплазией надпочечников, показана заместительная терапия глюкокортикоидами и в некоторых случаях - минералокортикоидами. Что касается аномалий половых органов, то решение об их коррекции следует принимать строго индивидуально. Больные с мужским гермафродитизмом бесплодны, что нужно принимать во внимание при выборе пола. У лиц с женским генотипом выбор пола не встречает трудностей (которые имеются при диагностике): больные воспитываются как женщины, в возрасте ожидаемого полового созревания им следует назначать заместительную терапию эстрогенами, чтобы индуцировать нормальное развитие женских вторичных половых признаков. Если же амбисексуальные половые органы находят у новорожденного мальчика, то решение вопроса о том, воспитывать ли его как мужчину или как женщину, зависит от анатомического дефекта; как правило, при более тяжелых нарушениях ребенка следует воспитывать как девочку и, по возможности, раньше производить хирургическую пластику половых органов и удаление яичек. Лицам, воспитанным в женском поле, в соответствующем возрасте также показана эстрогенная терапия, чтобы обеспечить нормальное развитие женских вторичных половых признаков. У лиц, воспитанных в мужском поле, следует производить хирургическую коррекцию любой имеющейся гипоспадии, а во время ожидаемого полового созревания строго следить за уровнем андрогенов и эстрогенов в плазме, чтобы определить необходимость хроническою дополнительного лечения тестостероном.
Нарушение синтеза андрогенов вследствие аплазии клеток Лейдига.
1.Вследствие генетических мутации лютеинизирующего гормона
Известна только одна мутация в гене бета субъединицы лютеинизирующего гормона. Мутантный гормон утрачивает способность связываться с рецептором клетки-мишени. Утрата биологической активности лютеинизирующего гормона приводит к нарушению стероидогенеза. Клиническая картина у мужчин характеризуется выраженным гипогонадизмом из-за снижения функциональной активности клеток Лейдига и их аплазии. В крови мужчин обнаруживают низкий уровень тестостерона, недоразвитие наружных половых органов, часто бесплодие. Дифференцировка пола по мужскому типу внутренних и наружных гениталий в период эмбрионального развития не страдает. Это связано с тем, что хорионический гонадотропин в период внутриутробного развития компенсирует недостаток или отсутствие действия лютеинизирующего гормона.
2. Вследствие генетических мутации рецептора лютеинизирующего гормона.
Наибольшее количество мутаций описано для гена рецептора лютеинизирующего гормона. Это мутации двух типов: активирующие и инактивирующие рецептор. Активирующие мутации приводят к преждевременному половому развитию в связи с тем что тестостерон в клетках Лейдига (в клетках-мишениях) вырабатывается даже без активирующего влияния лютеинизирующего гормона. В данном случае речь пойдет об инактивирующих мутациях.
В 1995 г. была найдена первая рецессивная инактивирующая мутация гена рецептора лютеинизирующего гормона у мужского гермафродита с гипоплазией клеток Лейдига.
В последующем было открыто еще семь инактивирующих мутаций гена рецептора лютеинизирующего гормона, которые расположены в разных частях гена. Эти мутации вызывают нарушение проведения сигнала при воздействии лютеинизирующего гормона. Однако имеются мутации, которые связаны с изменениями во внеклеточной части рецептора. Эти мутации приводят к уменьшению способности рецептора связываться с лютеинизирующим гормоном. Инактивирующие мутации в зависимости от характера повреждений определяют целый спектр клинических проявлений.
Наиболее тяжелые последствия гомозиготного носительства этих мутаций проявляются в период дифференцировки мужского пола в эмбриогенезе. В результате формируется мужской псевдогермафродитизм, который обусловлен нарушением синтеза тестостерона эмбриональными яичками из-за гипоплазии клеток Лейдига или полного их отсутствия. Степень недоразвития яичек определяет степень нарушения дифференцировки наружных половых органов мальчиков. Клинический полиморфизм обусловлен генетическим гетероморфизмом, который определяет степень остаточной активности рецептора лютеинизирующего гормона.
При мягких формах патологии в отличие от классического варианта мужского псевдогермафродитизма формируется гипогонадизм, при этом наружные половые органы мужского типа имеют выраженную гипоплазию. Эти формы следует отличать от гипогонадизма у мужчин, обусловленного носительством мутаций в гене бета-субъединицы лютеинизирующего гормона. При наличии мутаций в гене бета субъединицы лютеинизирующего гормона в период эмбриогенеза на функцию эмбриональных яичек оказывает влияние хорионический гонадотропин, бета-субъединица которого биологически идентична бета-субъединице лютеинизирующего гормона. Введение экзогенных препаратов лютеинизирующего гормона позволяет провести дифференциальную диагностику гипогонадизма у мужчин, обусловленную либо мутациями в гене бета-субъединицы лютеинизирующего гормона, либо мутациями в гене рецептора лютеинизирующего гормона. Хороший клинический эффект достигается только в первом случае.
Нарушения действия андрогенов.
Некоторые нарушения формирования мужского фенотипа обусловлены дефицитом действия андрогенов. При данной патологии образование тестостерона и регрессия мюллеровых протоков протекают нормально, но вследствие резистентности клеток-мишеней к действию андрогенов развитие по мужскому типу в тон или иной степени нарушается.
Недостаточность 5a-редуктазы.
Эта аутосомно-рецессивная форма мужского псевдогермафродитизма характеризуется:
- наличием у больных тяжелой промежностно-мошоночной гипоспадии с капюшонообразной крайней плотью, вентральной уретральной бороздкой и отверстием уретры в основании полового члена;
- наличием слепого влагалищного кармана разных размеров, открывающегося либо в урогенитальный синус, либо на уретре кзади от ее отверстия;
- наличием хорошо развитых яичек с нормальными придатками, семявыносящими протоками и семенными пузырьками, причем эякуляторные пути открываются в слепо заканчивающееся влагалище;
- женским телосложением больных, не сопровождающимся развитием молочных желез по женскому типу; наличием нормального подмышечного и лобкового оволосения:
- отсутствием женских внутренних половых органов;
- наличием нормального для мужчин уровня тестостерона в плазме и
- разной степенью маскулинизации больных в период полового созревания.
То обстоятельство, что нарушение вирилизации в процессе эмбриогенеза ограничивается урогенитальным синусом и закладкой наружных половых органов, позволяет понять природу главного дефекта. Тестостерон, секретируемый яичками плода, служит внутриклеточным медиатором дифференцировки вольфова протока в придаток яичка, семявыносящий проток и семенной пузырек, но вирилизация урогенитального синуса и наружных половых органов опосредуется дигидротестостероном. Следовательно, у эмбриона мужского пола с нормальным синтезом тестостерона и нормальными рецепторами андрогенов формирование фенотипа, свойственного индивиду при данном нарушении (нормальные производные вольфовых протоков с недостаточной маскулинизацией структур, образующихся из урогенитального синуса, полового бугорка и половых складок), следовало было бы ожидать при недостаточном образовании дигидротестостерона. Поскольку секреция лютеинизирующего гормона регулируется самим тестостероном, содержание этого гормона в плазме у таких больных повышено лишь незначительно. Поэтому интенсивность продукции тестостерона и эстрогенов остаются характерными для нормальных мужчин и гинекомастия не развивается.
Патология рецепторов андрогенов.
Патология рецепторов андрогенов может приводить к формированию нескольких разных фенотипов. Несмотря на различия в клинической картине и молекулярных основах, эти нарушения имеют сходные эндокринологические, генетические и патофизиологические аспекты.
1. Синдром тестикулярной феминизации.
Кариотип - мужской 46 XY.
Протекает с нарушением полового развития и имеющий выраженный семейный характер. Передается женщинам - носительницам патологического гена, у них отмечается слабое половое оволосение, позднее начало менструаций.
Показано, что при данном синдроме снижены, либо полностью отсутствуют рецепторы к андрогенам в клетках некоторых тканей. При отсутствии реакции тканей на половой гормон тоническая секреция гонадотропинов повышается. При тестикулярной феминизации резко повышено содержание лютеинизирующего гормона в крови. Гонадотропины, взаимодействуя со специфическими рецепторами, расположенными внутри клеточных мембран не только реагируют с рецепторными белками, но и влияют на их образование. Большие количества лютеинизирующего гормона тормозят собственные рецепторы. Несмотря на ареактивность тканей к андрогенам, происходит нормальная маскулинизация центров регулирующих секрецию гонадотропинов. Большинство исследователей считают, что в основе патогенеза лежит генетически обусловленная ареактивность тканей к андрогенам при сохраненной чувствительности к эстрогенам. Фетальные яички обладают антимюллеровыми свойствами что приводит к атрофии парамезонефральных протоков. Вследствие этого у больных отсутствует матка, маточные трубы и верхняя треть влагалища. Внутренние гениталии мужские, предстательной железы нет, есть слепой влагалищный отросток урогенитального синуса. При полной ареактивности тканей к андрогенам маскулинизации наружных гениталий не происходит и они сохраняют женское, нейтральное строение. Явления феминизации в пубертатном периоде объясняются повышенной продукцией эстрогенов яичками вследствие усиленной стимуляции гонадотропинами.
Выделяют две формы в зависимости от выраженности эстрогенного и андрогенного воздействия.
Для полной формы тестикулярной феминизации (частота встречаемости от 1:20000 до 1:64000 новорожденных мальчиков) характерно полное отсутствие чувствительности к андрогенам в результате чего больные имеют женский фенотип и правильное строение наружных гениталий. Синдром занимает третье по частоте место среди причин первичной аменореи у индивидов с женским фенотипом после дисгенезии гонад и врожденного отсутствия влагалища. В пубертатном периоде формируется женское строение тела, развиваются молочные железы. Половое оволосение чаще отсутствует или очень скудное, тогда как волосы на голове великолепные, внешность привлекательная, миловидная, женственная. Женщины обращаются к врачу либо по поводу паховой грыжи (в препубертатном возрасте), либо по поводу аменореи (после полового созревания). Наружные половые органы женские, клитор нормального или несколько уменьшенного размера. Влагалище короткое и заканчивается слепо, но может вообще отсутствовать или находится в рудиментарном состоянии. Все внутренние половые органы отсутствуют. У больных обнаруживают лишь неопущенные яички, содержащие нормальные клетки Лейдига, и семенные канальцы; сперматогенеза нет. Больные, как правило, высокого роста, костный возраст и психическое развитие в пределах нормы. Психосексуальная ориентация в отношении поведения, внешнего вида и материнских инстинктов женская.
При удалении яичек в препубертатном возрасте необходимо своевременно начинать терапию эстрогенами, чтобы обеспечить нормальный рост и развитие молочных желез. Если же кастрацию производят в постпубертатном возрасте, то заместительная эстрогенная терапия поможет предотвратить появление симптомов менопаузы и других осложнений отмены эстрогенов.
Неполная форма тестикулярной феминизации характеризуется частично сохранной чувствительностью органов-мишеней к андрогенам, что выражается в незавершенной маскулинизации наружных гениталий проявляющейся уже при рождении Синдром встречается примерно в 10 раз реже, чем полная форма.
В этих случаях незначительно выражена вирилизация наружных половых органов - частичное сращение лабиоскротальных складок и легкая клиторомегалия, нормальное оволосение лобка и некоторая вирилизация, равно как и феминизация во время ожидаемого полового созревания. Влагалище короткое и оканчивается слепо, но в отличие от полной формы патологии производные вольфовых протоков нередко бывают частично развитыми.
Лечение больных с полной и неполной формами тестикулярной феминизации различно. Поскольку у больных с неполной формой в возрасте ожидаемого полового созревания происходит вирилизация, гонадэктомию при наличии клиторомегалии или заднего сращения половых губ следует производить в препубертатном возрасте.
2. Синдром Рейфенштейна.
Чаще всего болезнь характеризуется наличием промежностно-мошоночной гипоспадии и гинекомастии, но проявления нарушений вирилизации в пораженных семьях различны - от фенотипических мужчин с азооспермией до фенотипических женщин с псевдовлагалищем.
Подмышечное и лобковое оволосение соответствует полу, но оволосение груди и лица выражено в минимальной степени. Яички маленькие, часто наблюдаются крипторхизм, азооспермия. У некоторых больных отмечают аномалии производных вольфовых протоков, например, у них отсутствуют или недоразвиты семявыносящие протоки. Поскольку психосексуальная ориентация больных в большинстве случаев, безусловно, мужская, гипоспадию и крипторхизм следует корригировать хирургическим путем. Единственно успешный способ лечения при гинекомастии - хирургическое удаление молочных желез.
3. Синдром мужского бесплодия при патологии андрогенных рецепторов.
Встречается часто и в действительности не представляет собой какой-либо формы мужского псевдогермафродитизма. В некоторых случаях этот синдром является единственным проявлением семейного синдрома Рейфенштейна. Бесплодие у членов пораженной семьи обусловлено азооспермией вследствие рецепторных нарушений.
Чаще же больные с мужским бесплодием не имеют семейного анамнеза. Патология рецепторов андрогенов может иметь место у 20% и более всех мужчин с идиопатической азооспермией. Эффективного лечения при любом из этих состояний нет.
Для всех синдромов с патологией рецепторов андрогенов характерен кариотип 46,XY, а мутантный ген сцеплен с Х-хромосомой. Семейный анамнез имеют примерно 60% больных с тестикулярной феминизацией и синдромом Рейфенштейна и отдельные больные с синдромом мужского бесплодия. Считают, что при отсутствии семейного анамнеза случаи заболевания обусловлены новыми мутациями.
Динамика гормонов при всех синдромах нарушения рецепторов андрогенов сходна. Содержание тестостерона в плазме и скорость его продукции яичками в пределах нормы или повышены. Повышение скорости продукции тестостерона обусловлено высокой средней концентрацией лютеинизирующего гормона в плазме, что в свою очередь объясняется нарушением механизма обратной связи вследствие резистентности гипоталамо-гипофизарной системы к действию андрогенов. Повышение содержания лютеинизирующего гормона определяет, вероятно, и увеличенную продукцию эстрогенов яичками. Гормональные сдвиги при синдроме мужского бесплодия сходны с таковыми при других аномалиях рецепторов, по менее выражены. У некоторых больных с этим синдромом содержание лютеинизирующего гормона или тестостерона в плазме не повышается.
Феминизацию при описываемых нарушениях обусловливают два взаимосвязанных обстоятельства.
Во-первых, андрогены и эстрогены на периферическом уровне обладают противоположными эффектами, и у здоровых мужчин вирилизация происходит при отношении андрогенов к эстрогенам 100:1 или выше; в отсутствие эффекта андрогенов действие эстрогенов на клетки не встречает сопротивления.
Во-вторых, продукция эстрадиола превышает таковую у здоровых мужчин (хотя она и меньше, чем у здоровых женщин). Различная степень резистентности к андрогенам вместе с различной степенью повышения продукции эстрадиола и объясняет отличие признаков нарушения вирилизации и усиления феминизации при всех клинических синдромах.
Резистентность при наличии рецепторов.
Разновидность резистентности к андрогенам, которая, по-видимому, не связана ни с дефицитом 5a-редуктазы, ни с нарушением рецепторов андрогенов, впервые была обнаружена в семье с синдромом тестикулярной феминизации. Затем были описаны больные с различными фенотипами - от неполной тестикулярной феминизации до синдрома Рейфенштейна.
Гормональные сдвиги в этих случаях сходны с таковыми при патологии рецепторов. Природа молекулярного нарушения у таких больных остается неясной. Синдром мог бы быть связан с настолько тонкими аномалиями рецепторов андрогенов, что их не удается обнаружить обычными методами. Если же дефект действительно локализуется дистальное рецептора, то он мог бы заключаться в неспособности клеток генерировать специфические информационные РНК или в нарушении процессинга РНК. На самом деле это заболевание может представить собой гетерогенную группу молекулярных нарушений. Лечение больных зависит от их фенотипа.
Синдром персистенции мюллеровых протоков.
Среди нарушений дифференцировки пола одним из наиболее редких вариантов можно считать синдром персистенции мюллеровых протоков (описано около 100 случаев), относящийся к группе ложного мужского гермафродитизма и клинически проявляющий себя наличием матки, влагалищного отростка урогенитального синуса и маточных труб у лиц мужского пола. При этом пораженные мужчины имеют нормальный половой член и по-разному развитые семявыносящие протоки. У пациентов нет признаков андрогенной недостаточности во внутриутробном периоде: кавернозные тела, головка, уретра развиты правильно по мужскому типу. Больные часто обращаются к врачу по поводу паховой грыжи, в которой находится матка; нередко обнаруживается и крипторхизм.
Семейный анамнез в большинстве случаев неинформативен, но описано несколько пар сиблингов, у которых данный синдром должен был бы наследоваться либо как аутосомно-рецессивная, либо как сцепленная с Х-хромосомой рецессивная мутация. Поскольку наружные половые органы хорошо развиты и в пубертатном возрасте происходит нормальная маскулинизация больных, полагают, что на критической стадии половой дифференцировки яички вырабатывают нужное количество андрогенов. Однако регрессии мюллеровых протоков не происходит, что можно объяснить неспособностью яичек плода продуцировать антимюллеровский гормон, несвоевременной продукцией этого вещества или неспособностью тканей реагировать на этот гормон.
Биологическая функция антимюллеровского гормона, продуцируемого клетками Сертоли яичка, заключается в подавлении развития дериватов мюллерова протока у плода. Его секреция начинается сразу после дифференцировки гонад по мужскому типу, т.е. на 7-8 недели эмбрионального развития. При недостаточном действии антимюллеровского гормона вследствие нарушения его выработки или нечувствительности рецепторов к нему (соотношение встречаемости этих патогенетических форм примерно одинаково) не происходит регресса мюллеровых протоков, и у плода мужского пола развивается матка, фаллопиевы трубы, верхние 2/3 влагалища.
Выделяют следующие клинические варианты синдрома персистенции мюллеровых протоков:
- Первый вариант характеризуется крипторхизмом с одной стороны и наличием паховой грыжи с другой. Как правило, при этом отмечается поперечная эктопия яичка.
- Втором вариант характеризуется тем, что оба яичка располагаются в широкой связке матки.
Генетически эти две формы не отличаются. При синдроме персистенции мюллеровых протоков яички дифференцированы нормально и содержат половые клетки, но нередко из-за аплазии придатка и верхней части выносящих протоков напрямую связаны с экскреторным протоком.
Чтобы свести к минимуму опасность возникновения опухоли и сохранить вирилизацию, следует производить одномоментную или поэтапную орхопексию. Злокачественные новообразования матки или влагалища не описаны, и, поскольку семявыносящие протоки тесно ассоциированы с широкими связками, матку и влагалище во время операции трогать не нужно, чтобы избежать травмы семявыносящих протоков и тем самым сохранить возможную фертильность.
Считают, что бесплодие у пациентов с СПМП может быть связано с неадекватным оперативным лечением, вторичной андрогенной недостаточностью, а также с диспропорцией соотношения структур придатка яичка и семявыносящих протоков.
Изолированные нарушения развития мужских половых органов и мужской репродуктивной функции.
Изолированные дефекты развития мужских половых органов.
Гипоспадия.
Гипоспадия - это врожденная аномалия, при которой уретра открывается по средней линии вентральной поверхности полового члена между нормальным расположением отверстия уретры и промежностью. Данный порок развития часто сопровождается той или иной степенью вентрального подтягивания и изгиба полового члена. В США встречается у 0,5-0,8% новорожденных мальчиков.
Поскольку развитие полового члена опосредуется андрогенами, предполагают, что гипоспадия связана с каким-то ранним нарушением образования или действия андрогенов в процессе эмбриогенеза. Действительно, гипоспадия встречается при большинстве нарушений мужской половой дифференцировки. Иногда этот порок развития вызван приемом матерью на ранних стадиях беременности прогестиновых препаратов. В настоящее время известны причины (дефекты одиночного гена, хромосомные аномалии и прием матерью фармакологических средств) примерно 25% случаев гипоспадии, а причины большинства из них остаются неизвестными.
Крипторхизм.
Нормальный процесс опущения яичек - это, вероятно, хуже всего изученный аспект мужской половой дифференцировки как в отношении природы сил, вызывающих перемещение яичек, так и гормональных факторов, регулирующих этот процесс.
С анатомических позиций опущение яичек можно разделить на три стадии:
- трансабдоминальное их перемещение от места образования над почками к паховому кольцу;
- формирование отверстия в паховом канале (вагинальный отросток), через которое яички покидают брюшную полость;
- прохождение яичек через паховый канал в мошонку.
Весь этот процесс занимает 6 - 7 месяцев беременности, начинаясь примерно на 6-й неделе и не заканчиваясь полностью у некоторых здоровых мальчиков даже к моменту рождения. Если андрогены и принимают участие в этом процессе, они, по-видимому, не являются единственными гормонами, обусловливающими нормальное опущение яичек. Если какой-либо из перечисленных выше процессов не произойди, это может привести к неопущению одного или обоих яичек, что встречается у 3% доношенных новорожденных мальчиков и у 30% недоношенных плодов мужского пола.
Предложены две основные теории возникновения крипторхизма - недостаточное интраабдоминальное давление и недостаточная эндокринная функция яичек вследствие нарушения синтеза тестостерона, либо вследствие недостаточного образования антимюллеровского гормона. То обстоятельство, что мужчины, леченные по поводу как одностороннего, так и двустороннего крипторхизма, часто бесплодны, свидетельствует о том, что неопущение яичек скорее является следствием, а не причиной нарушения их функции.
Изолированные дефекты развития мужской репродуктивной системы.
Аплазия герминативного эпителия (синдром только клеток Сертоли, синдром Дель Кастилио)
Впервые описан в 1947 г. у бесплодных мужчин с азооспермией, с нормальным мужским фенотипом и кариотипом и с сохраненной половой функцией.
Аплазия герминативного эпителия не является диагнозом, а лишь характеризует гистопатологический фенотип. Такое состояние паренхимы яичка описано как синдром, включающий незначительно уменьшенные в размерах яички нормальной консистенции, азооспермию и повышенный уровень ФСГ.
Большинство исследователей относят этот синдром к врожденной первичной гипергонадотропной форме гипогонадизма с ранней атрофией герминативного эпителия. Повреждающий фактор, действующий избирательно на герминативные структуры яичек, не известен. Роль генетических факторов в его этиологии пока не подтверждена.
Пациенты в физическом и половом развитии соответствуют нормальным мужским параметрам. Обычно обращаются с жалобой на бесплодие. Половая функция не страдает. Анамнестические данные обычно не дают оснований для уточнения причин бесплодия. При оценке андрологического статуса не выявляется существенных отличий.
В детском возрасте синдром ничем себя не проявляет. Половое созревание, как правило, не запаздывает, степень маскулинизации организма и темпы развития сексуальности - без отклонений от условной нормы. Крайне редко наблюдаются черты евнухоидизма.
При оценке андрологического статуса взрослого не отмечается существенных отклонений.
При гистологическом исследовании яичка размеры семенных канальцев уменьшены, но склероза и гиалинизации нет. Клетки сперматогенного эпителия полностью отсутствуют, в семенных канальцах определяются лишь клетки Сертоли. Клетки Лейдига сохранены
Данные электронно-микроскопических исследований биоптатов яичек показали, что в 40-80% случаев имеют место нормальные клетки Лейдига, в 20-60% - либо патологически дифференцированные, либо находящиеся на различных стадиях развития.
Половой хроматин положительный, кариотип 46XY. На фоне нормального содержания тестостерона в крови выявляется высокий уровень фолликулостимулирующего гормона, концентрация лютеинизирующего гормона не изменена. Последним арбитром в постановке диагноза служит биопсия яичек
Прогноз в отношении плодовитости неблагоприятен. Терапия андрогенами показана лишь в редких случаях проявления андрогенной недостаточности.
Следует отметить, что и при других заболеваниях яичек в семенных канальцах могут наблюдаться только клетки Сертоли (крипторхизм, синдром Клайнфелтера, орхит). Однако, при этом, в отличие от синдрома Дель Кастильо, яички обычно маленькие, а при гистологическом исследовании преобладающим признаком является выраженный склероз и гиалинизация семенных канальцев.
Синдром неподвижных ресничек
Полное отсутствие подвижных сперматозоидов в эякуляте может свидетельствовать в пользу синдрома неподвижных ресничек. Известно, что реснички мерцательного эпителия и хвосты сперматозоидов у пациентов с синдромом неподвижных ресничек поражаются практически одинаково. Это дает основание рассматривать синдром неподвижных ресничек как одно из проявлений первичной реснитчатой дискинезии, которая характеризуется ослабленной или отсутствующей подвижностью ресничек в дыхательных путях и в других реснитчатых органах.
Классическим проявлением такого заболевания является синдром Картагенера - триада: situs inversus (обратное расположение внутренних органов), бронхоэктазы и риносинусит. Гораздо чаще встречается так называемый "неполный синдром Картагенера", представленный двумя последними признаками. Клинически реснитчатая дискинезия проявляются уже в детстве: хронические синуситы и риниты, хронический кашель с отхаркиванием мокроты. Большинство пациентов с синдромом неподвижных ресничек стерильны.
При исследовании эякулята объем и морфология обычно в пределах нормы, а подвижность сперматозоидов резко снижена, либо отсутствует.
Так как в создание ресницы вовлечено много генов, то повреждение любого из них может приводить к структурным или функциональным расстройствам. Поэтому, попытки картировать отдельный ген для синдрома Картагенера не увенчались успехом.
Глобулозооспермия.
Синдром округлых головок и полная агенезия акросомы (глобулозооспермия). Данные электронно-микроскопического изучения клеток эякулята пациентов с синдромом округлых головок сперматозоидов свидетельствуют о том, что существуют два подтипа головок.
Один подтип - сперматозоиды при истинном синдроме округлых головок, характеризующиеся полной потерей акросомы и деконденсированным хроматином. В аксонеме и жгутике таких сперматозоидов микротрубочки и митохондрии часто аномальны.
При втором подтипе округлых сперматозоидов также определяется аномальное распределение хроматина, но акросома формируется. В данных случаях акросомная реакция может быть не нарушена.
Так как имеются публикации о семейных случаях синдрома округлых головок сперматозоидов, предполагается генетическая природа данной патологии по аутосомно-доминантному типу. Также есть мнение о полигенном характере наследования. Характер аномалии ультраструктуры сперматозоидов, по-видимому, зависит от типа мутации соответствующих генов и степени их экспрессии. Агенезия акросомы приводит к необратимому бесплодию. Беременность может наступить у половых партнерш пациентов с глобулозооспермией лишь при использовании интрацитоплазматической инъекции сперматозоидов (ИКСИ). Так как при ИКСИ отсутствует селекция гамет, важно определить степень риска переноса потомству генетического дефекта. Было показано, что у пациентов с глобулозооспермией частота анеуплоидии в половых клетках выше по сравнению с контрольной группой. Эти данные заставляют с осторожностью подходить к включению пациентов с глобулозооспермией, обусловленной агенезией акросомы, в программу ИКСИ.
Азооспермия вследствие микроделеций AZF-локуса Y-хромосомы.
Причиной генетически обусловленного мужского бесплодия, связанного с нарушением сперматогенеза, является мутация в одном из локусов хромосомы Y. Этот локус назвали фактором азооспермии (AZF). Локализация AZF в районе Yq11 была подтверждена молекулярными исследованиями. С 1976 г. начались интенсивные исследования хромосомы Y и была построена её цитогенетическая, физическая и патологическая карта.
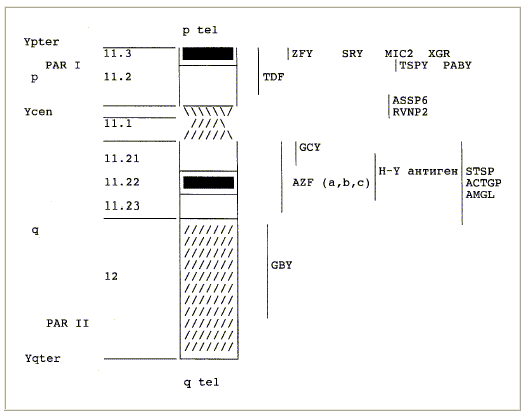
В норме хромосома Y - одна из самых небольших по длине в кариотипе человека. Хромосома Y делится на три участка: эухроматиновое короткое плечо Yp11, эухроматиновая проксимальная часть длинного плеча Yq11 и гетерохроматиновый дистальный участок длинного плеча Yq12. Хромосома Y человека включает около 50 млн. нуклеотидных пар, причем 60% ДНК находится в гетерохроматиновой области Yq12. Физическая протяженность короткого плеча Yp11 оценена примерно в 13 млн. нуклеотидных пар. Эухроматиновая часть длинного плеча Yq11 не превышает 7 млн. нуклеотидных пар. На хромосоме Y локализовано более 100 генов и последовательностей ДНК, функции 16 из них определены.
Гены короткого плеча хромосомы Yp11 транскрибируются на разных этапах формирования органов репродуктивной системы и во время сперматогенеза. В этом участке с помощью молекулярных методов были обнаружены 2 гена, транскрибирующиеся в клетках яичка, названные ZFY (белок цинковых пальцев - zinc finger protein) и TSPY (тестисспецифический белок - testis specific protein). Мутации этих генов у стерильных мужчин до сих пор не описаны, роль их в сперматогенезе не ясна. На коротком плече хромосомы Yp11 локализован ген, который получил название SRY (определяющий пол участок - sex determining region). Он имеет консервативную структуру, ответствен за развитие яичек. Его фрагмент в 35 тыс. 13 млн. нуклеотидных пар представляет минимальную последовательность ДНК хромосомы Y, достаточную для формирования мужского фенотипа.
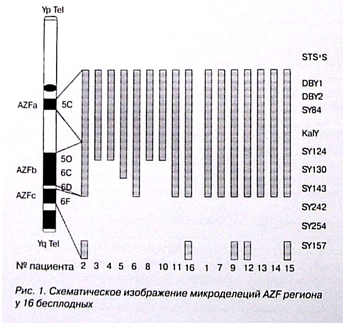
В длинном плече хромосомы Y картированы гены, ответственные за репродуктивную функцию. Помимо AZF (фактора азооспермии), обнаружен ген, кодирующий специфический для мужчин мембранный клеточный белок - Н-Y антиген, который долго считали первичным фактором регуляции пола. Н-Y антиген локализован в непосредственной близости к локусу AZF. Очевидно, функция этого белка связана с формированием семенных канальцев. Имеются и другие гены длинного плеча хромосомы Y, не участвующие в формировании и функционировании половых органов. Ген GBY (гонадобластомы) рассматривается как онкоген, провоцирующий опухоли в дисгенетичных гонадах, развивающихся при мозаицизме 45,Х/46,XY. Другой ген - GCY контролирующий рост (growth control), локализован в проксимальной части Yq11. Его делеция или нарушение в нем последовательности ДНК обусловливает низкорослость.
Основное внимание в настоящее время привлекает к себе ген, контролирующий гаметогенез у мужчин. Он расположен в эухроматиновой части длинного плеча хромосомы Y и называется - фактор азооспермии (AZF).
Хотя AZF присутствует во всех клетках, кроме эритроцитов, он активен только в клетках Сертоли. В 1996 г. с помощью молекулярных методов была установлена неоднородная структура этого гена. Микроделеции, вызывающие нарушения репродуктивной функции у мужчин, были картированы в трех различных субрегионах Yq11. Один из субрегионов соответствующий локусу AZF, располагается в дистальной части Yq11, второй и третий картированы проксимальнее первого. У пациентов с микроделециями этих локусов выявлено нарушение сперматогенеза на различных стадиях, в зависимости от потери определенного участка AZF. Последствием нарушения в каждой из указанных последовательностей является азооспермия или олигозооспермия тяжелой степени, поэтому эти локусы получили названия AZFa, AZFb и AZFc. Изучается их роль в процессе сперматогенеза.
Нарушения половой дифференцировки вследствие генных мутации аутосом или вследствие воздействия эмбриотоксических факторов.
Нарушения половой дифференцировки могут быть обусловлены не только хромосомными аберрациями, но и генными мутациями и различными эмбриотоксическими факторами. Вследствие этого в практике встречается множество синдромов протекающих с теми или иными признаками нарушений полового развития. Ниже приведено ряд синдромов в ядерные признаки (т.е. встречается в 80% наблюдений этого синдрома) которых входят некоторые проявления нарушений полового развития.
Миотоническая дистрофия: миотония (задержка расслабления мышц после их сокращения), помутнение хрусталика, облысение лба и атрофия яичек .
У 80% больных миотонической дистрофией наблюдается атрофия яичек, напоминающая таковую при синдроме Клайнфелтера, которая, однако, не связана с Х-хромосомой.
Генетический дефект при миотонической дистрофии обусловлен нарушением числа последовательностей ЦГТ (цитозин-тиамин-гуанин). Количество нестабильных повторов ЦТГ в гене, который кодирует белок протеиназу и который расположен в длинном плече 19-й хромосомы, увеличивается от 50 до 2500. В норме число ЦТГ-повторов - 5-30.
Атрофия яичек наступает после полового созревания в различные периоды зрелости. Повреждения семенных канальцев варьируют от умеренной дезорганизации семенного эпителия до полного фиброзного перерождения канальцев. Клетки Лейдига сохранены.
Концентрация ФСГ плазмы крови повышена всегда. Бесплодие необратимо.
Синдром Перрольта: глухота, тугоухость; гипогонадизм; нанизм; атаксия; задержка интеллектуального развития; короткая шея; сколиоз. Наследуется по аутосомно-рецессивному типу.
Синдром Вудхауза олигофрении - глухоты - гипогонадизма: задержка интеллектуального развития; глухота, тугоухость; гипогонадизм; сахарный диабет; гипотрихоз скальпа; аплазия и гипоплазия бровей; Наследуется по аутосомно-рецессивному типу.
Синдром Де Груши олигофрении - нанизма - инверсии пола: задержка интеллектуального развития; микроцефалия; а-, гипоплазия, однорогая матка; инверсия пола, ХУ дисгенез; нанизм пропорциональный; гирсутизм, густые брови, большой нос; а-, гипоплазия, дисгенезия яичников; гипоплазия половых губ и др. Наследуется по аутосомно-рецессивному типу.
Синдром Майнека полидактилии - мочеполовых аномалий: аплазия и гипоплазия почек; опухоли половых желез; пренатальная гипоплазия и др. Неуточненный тип наследования.
Синдром Тиби олигофрении - ожирения - гипогонадизма: задержка интеллектуального развития; гинекомастия; гипогонадизм; ожирение; арахнодактилия кисти; сутулость; Х-образное искривление ног и др. Наследуется по аутосомно-рецессивному типу.
Синдром ульнаро - маммарный: гипоплазия сосков; гипогонадизм; аплазия или гипоплазия 4-5 пальцев кисти или стопы; микроцефалия; нанизм; ожирение; евнухоидное сложение и др..
Синдром Хеймета глухоты - нефропатии - гипогонадизма: глухота, тугоухость; нефропатия, протеинурия; гипогонадизм; начало заболевания после 5 лет; Наследуется по аутосомно-рецессивному типу.
Синдром Аль - Эвейди гипотрихоза - гипогонадизма; аплазия или гипоплазия яичек; гипогонадизм; очаговая алопеция; гипотрихоз тела; Наследуется по аутосомно-рецессивному типу.
Синдром Бернара - Уэйла, неврологических аномалий - гипогонадизма: атаксия; дизартрия, гипогонадизм; высокий свод стопы; начало заболевания после 10 лет; Наследуется по аутосомно-рецессивному типу.
Синдром Фразье гонадального дисгенеза - нефропатии: нефропатия; инверсия пола, ХУ дисгенез. Неуточненный тип наследования.
Синдром Бенгстеда олигофрении - нанизма - гипогонадизма: атаксия; задержка интеллектуального развития; микроцефалия; гипогонадизм; нанизм; сахарный диабет и др. Наследуется по аутосомно-рецессивному типу.
Синдром Броснека олигофрении - нанизма - инверсии пола: задержка интеллектуального развития; тригонцефалия; атрезия и стеноз слуховых проходов; инверсия пола, ХУ дисгенез; нанизм; Наследование по аутосомно-рецессивному типу.
Синдром Малоуфа кардиопатии - гипогонадизма: птоз век; широкая, высокая спинка носа, переносье; кардиопатия; гипогонадизм и др. Наследуется по аутосомно-рецессивному типу.
Синдром Неумена множественной гипоплазии эндокринных желез: аплазия и гипоплазия гипофиза, щитовидной железы, надпочечников; аплазия и гипоплазия яичек. Наследуется по аутосомно-рецессивному типу.
Синдром Вейнштейна глухоты - катаракты - нанизма - гипогонадизма: катаракта; глухота, тугоухость; гипогонадизм; нанизм; ожирение.
Синдром Фриска аномалий лица - гипогонадизма: задержка интеллектуального развития; энофтальм; широкая спинка носа, переносье; гипогонадизм; евнухоидное сложение и др. Наследуется по аутосомно-рецессивному типу.
Синдром Фитч нанизма - аномалий кистей - гипогонадизма: гипогонадизм; нанизм; изодактилия; аплазия и гипоплазия фаланг кистей и др. Наследуется по аутосомно-доминантному типу.
Синдром Фамизимы акромегалии - черного акантоза: широкая спинка носа, толстые губы, макрогения; гипогонадизм; нанизм; брахидактилия; черный акантоз; нечувствительность к инсулину. Наследуется по аутосомно-рецессивному типу.
Следует отметить, что распространенность в популяциях вышеперечисленных синдромов невелика: для подавляющего большинства данных нозологий составляет 1:200000-500000.
При написании статьи использовалась работа Джин Д. Вилсон, Джеймс Е. Гриффин Ш (JeanD. Wilson, JamesE. GriffinШ) «НАРУШЕНИЯ ПОЛОВОЙ ДИФФЕРЕНЦИРОВКИ».
Первичный приобретённый гипогонадизм.
Первичный приобретенный гипогонадизм - гипогонадное состояние в результате воздействия на яичко внешних или внутренних факторов после рождения.
Яички в значительно большей степени подвержены воздействию неблагоприятных факторов внешней и внутренней среды, чем другие ткани организма. Причинами повышенной ранимости яичек часто является их тканевая специфика.
- Во-первых, образование сперматозоидов и стероидных гормонов - это биологически очень активные процессы, а, как известно, такие процессы наиболее чувствительны к воздействию неблагоприятных факторов.
- Во вторых, процесс образования сперматозоидов возможен только при температуре на 2-4 градуса ниже, чем температура тела. Поэтому воспалительные заболевания органов мошонки, лихорадки, венозный застой, неопущение яичек в мошонку - все факторы, приводящие к перегреву яичек - вызывают значительные, а иногда и необратимые, нарушения тестикулярной ткани.
- В третьих, ткань яичка не обладает иммунологической толерантностью, иммунная система воспринимает ткань яичка, как чужеродную. Поэтому при нарушении гематотестикулярного барьера легко развивается аутоиммунный воспалительный процесс. Причиной нарушений гематотестикулярного барьера может являться воспалительный процесс, травма, операция, нарушения кровообращения в яичке.
Чаще всего в первую очередь страдает спермообразующая функция и структуры семенных канальцев и клеток Сертоли. Далее при длительном воздействии повреждающего фактора нарушается гормонпродуцирующая функция яичек с постепенным развитием андрогенной недостаточности.
Степень нарушения гипоталамо-гипофизарной системы зависит от степени и локализации повреждения элементов яичек. В случае преимущественного нарушения спермообразующей функции - повышается уровень фолликулостимулирующего гормона и сохраняется нормальный уровень лютеинизирующего гормона. При недостаточности гормонпродуцирующей функции и клеток Лейдига - повышается уровень лютеинизирующего гормона. Изменения в системе гипофиз - яички могут быть обратимыми или стойкими в зависимости от степени повреждения, длительности воздействия и возраста пациента.
Причины первичного приобретенного гипогонадизма разнообразны.
Классификация первичного приобретённого гипогонадизма:
- 1. Первичная приобретенная недостаточность герминативного эпителия
(ложный синдром Клайнфелтера).
- 2. Первичная приобретенная недостаточность клеток Лейдига.
- 3. Первичный приобретённый гипогонадизм вследствие двухстороннего крипторхизма.
- 4. Первичный приобретённый гипогонадизм вследствие двухстороннего орхита или орхоэпидидимита.
5. Первичный приобретённый гипогонадизм вследствие травматического поражений яичек.
6. Первичный приобретённый гипогонадизм токсического поражения яичек:
- под воздействием инфекционной интоксикации (малярийной, туберкулезной, септической, на фоне скарлатины и пневмонии)
- под воздействием химических агентов, в том числе производственных
- под воздействием лекарственных препаратов
- под воздействием бытовых интоксикаций (алкогольных и наркотических)
7. Первичный приобретённый гипогонадизм вследствие воздействия проникающей радиацией.
8. Первичный приобретённый гипогонадизм вследствие патологии внутренних органов.
9. Первичный приобретённый гипогонадизм вследствие воздействия факторов окружающей среды:
- повышения температуры окружающей среды
- переохлаждения
- вибрации
10. Первичный приобретённый гипогонадизм вследствие нарушений кровообращения в яичках при хирургической патологии.
11. Первичный приобретённый гипогонадизм вследствие нарушения иннервации яичка.
12. Первичный приобретённый гипогонадизм вследствие воздействия феминизирующих карцином.
Если первичный приобретенный гипогонадизм возникает в детском возрасте до пубертатного периода, то формируются типичные признаки евнухоидизма и формирования вторичных мужских половых признаков не происходит.
Когда функция яичек нарушается у взрослого мужчины, то у него постепенно уменьшается выраженность мужских половых признаков, выпадают волосы на теле, увеличивается масса тела, постепенно возникает импотенция: уменьшается либидо, снижается количество эрекций и объем спермы, возникает бесплодие.
Фенотип мужчин при различных формах первичного приобретенного гипогонадизма.
1. Первичная приобретенная недостаточность герминативного эпителия (ложный синдром Клайнфелтера).
Клиническая картина соответствует истинному синдрому Клайнфелтера: больные высокого роста, евнухоидного телосложения, с проявлением гинекомастии (и без него), вторичные половые признаки недостаточно развиты. Яички маленькие, чаще плотные, размер полового члена - на нижней границе нормы. Интеллект сохранен.
Показатели гонадотропных и половых гормонов: высокий уровень фолликулостимулирующего гормона, низкий или нормальный тестостерон, нормальный уровень лютеинизирующего гормона. Характерный внешний облик и высокий уровень фолликулостимулирующего гормона, или обоих гонадотропинов, наводят на мысль о синдроме Клайнфелтера. Однако нормальный мужской кариотип 46XY и отрицательный половой хроматин позволяют заподозрить ложный синдром Клайнфелтера.
Проба с хорионическим гонадотропином обычно положительна, однако резервы тестикул значительно меньше, чем при гипогонадотропном гипогонадизме.
Биопсия яичка при ложном синдром Клайнфелтера точно соответствует таковой при истинном синдром Клайнфелтера: прогрессирующий гиалиноз семенных канальцев, их склерозирование с исчезновением генеративного эпителия. Интерстициальные эндокриноциты страдают меньше, иногда отмечают их аденоматозные скопления. Биопсия яичек является единственным дифференциально-диагностическим признаком отличающими его от других форм гипогонадизма.
Лечение в отношении плодовитости бесперспективно. При подозрении на ложный синдром Клайнфелтера в препубертатном и пубертатном возрасте необходима профилактика задержки пубертата и развития евнухоидизма. Заместительная терапия андрогенами показана при андрогенной недостаточности и жалобах на половую слабость.
2. Первичная приобретенная недостаточность клеток Лейдига.
Первичная приобретенная недостаточность тестикулярных эндокриноцитов сопровождается резким снижением продукции тестостерона, приводящего к повышению уровня лютеинизирующего гормона в крови. Секреция фолликулостимулирующего гормона остается нормальной или несколько повышенной, что свидетельствует о том, что канальцы остались интактными или пострадали в меньшей степени. У пациентов налицо все признаки гипогонадизма, к пубертатному периоду формируются евнухоидные черты, у взрослых - снижена фертильность. Дифференциальный диагноз с другими формами гипогонадизма основан на определении уровня тестостерона, фолликулостимулирующего и лютеинизирующего гормона. Проба с хорионическим гонадотропином отрицательная. Кариотип 46XY, половой хроматин не определяется.
Лечение - заместительная терапия тестостероном с учетом степени андрогенной недостаточности и возраста.
3. Первичный приобретённый гипогонадизм, как последствие двухстороннего крипторхизма.
В настоящее время под термином «крипторхизм» подразумевается состояние, при котором одно или оба яичка к моменту рождения не опустились в мошонку. Крипторхизм при рождении не является болезнью и наблюдается у 2 - 3% новорожденных. У недоношенных частота крипторхизма достигает 21%. В течение первого года жизни яички, как правило, самостоятельно опускаются в мошонку. Крипторхизм встречается у 0,8% взрослых мужчин.
Морфологические изменения в неопустившихся яичках начинают развиваться после 2-х летнего возраста. Причиной нарушений функции яичек при крипторхизме является воздействие более высокой температуры тела, чем в мошонке. Ведь нормальное функционирование яичка возможно только при температуре на 2-4 градуса ниже, чем температура тела. При этом возникают нарушения кровообращения яичек, что приводит к нарушению образования сперматозоидов и половых гормонов. При крипторхизме происходят дегенеративные изменения сперматогенного эпителия, а само неопустившееся яичко подвергается фиброзному или жировому перерождению. Выраженность этих изменений зависит от длительности крипторхизма. К 10-летнему возрасту в паренхиме яичка развиваются грубые склеротические процессы. Кроме того, наблюдения показывают, что у пациентов с односторонним крипторхизмом встречается дисгенезия не только неопуствшегося, но и нормального яичка. Несмотря на профилактическое проведение орхопексии, пациенты, страдающие односторонним крипторхизмом, имеют сниженный потенциал фертильности.
Если у мальчика при рождении не определяются яички, то обычно исключают женский псевдогермафродитизм или сочетанный двусторонний анорхизм (полное отсутствие яичек). Субъект, страдающий этим недостатком, в XIX веке назывался "нутрецом" или "монорхидиком".
От рождения до года нет необходимости применять какое-либо лечение ввиду того, что яички могут самостоятельно опуститься в мошонку. От года до двух лет следует проводить консервативное лечение с помощью хорионического гонадотропина.
Применение хорионического гонадотропина приводит к повышению уровня тестостерона, что клинически проявляется возникновением эрекций у ребенка, некоторым оволосением лобка, увеличением яичек в объеме и более агрессивным поведением. После окончания лечения эти эффекты исчезают.
Считается, что эффективность применения хорионического гонадотропина у детей до 2-летнего возраста достигает 20 - 50%. В возрасте ребенка до 3 лет положительный эффект гормонотерапии крипторхизма снижается до 20 - 25% .
При отсутствии эффекта от гормонального лечения, уже в 2-летнем возрасте следует применять оперативное лечение - низведение яичка. Следует отметить, что даже успешное низведение яичка вовсе не является гарантией того, что пациент в будущем сможет иметь детей. Крипторхизм часто сопровождается непроходимостью семявыводящих путей, особенно на уровне придатка яичка. Это связано с аномалиями развития (вплоть до полного отсутствия) придатка яичка. Частота анатомических аномалий придатка яичка при крипторхизме достигает 36 - 68%.
4. Первичный приобретённый гипогонадизм после перенесенного орхита и орхоэпидидимита.
Воспаление паренхимы яичек приводит к склеротическому перерождению тканей с последующей ее атрофией и развитием недостаточности спермообразующей и гормонпродуцирующей функции яичек. Первичный гипогонадизм возникает при двухстороннем воспалении яичек одномоментно или в разное время.
Причиной орхита может быть банальная патогенная или условно-патогенная микрофлора вызывающая острые и хронические заболевания половых органов (уретрит, простатит, везикулит, дефферентит), а может быть специфическая инфекция (туберкулез) или инфекция передающаяся половым путем (гонорея, трихомониаз, хламидиоз, микоплазмоз, сифилис и т.д.). При этом инфекции распространяются ретроградно из уретры или простаты через семявыносящий проток. Воспаление обычно начинается в придатке яичка, но далее переходит и на само яичко. Двухсторонний воспалительный процесс чаще всего встречается при мочеполовом туберкулезе, в 30% случаев хронического двухстороннего эпидидимита.
Изолированный орхит встречается реже и развивается в результате гематогенного заноса инфекции. При этом дегенеративные процессы носят медленный прогрессирующий характер. Гематогенный орхит может быть вирусного и бактериального генеза.
Вирусные орхиты.
Ни более распространенные возбудители - вирус эпидемического паротита, вирус Коксаки В и ЕСНО-вирусы, а также вирусы гриппа, ветряной оспы, кори, инфекционного
мононуклеоза. Наиболее тяжело вирусные орхиты протекают у взрослых, приводя к быстрой атрофии яичек и хронической орхалгии.
Бактериальные орхиты.
Гематогенные бактериальные орхиты встречаются при дифтерии, скарлатине, сыпном и брюшном тифе, паратифе, бруцеллезе, врожденном сифилисе, сепсисе.
В этой группе этиологических причин орхита особо выделяется эпидемический паротит (свинка). Эпидемический паротит у 15-25% мужчин осложняется острым орхитом.Если это происходит в препубертатном возрасте, то большинство пациентов полностью выздоравливает, но если яички поражаются во время полового созревания или у взрослых лиц, то возникает стойкое поражение семенных канальцев. В течение от 1 до 6 месяцев может развиться атрофия яичек. Нормальные показатели спермы восстанавливаются менее чем у 1/3 мужчин. Повреждения ткани яичка вследствие эпидемического паротита могут проявиться и не сразу, а через 10-20 лет после острого орхита. Яички постепенно становятся маленькими и плотными. Гистологически выявляется склероз и гиалинизация канальцев. Уровень ФСГ обычно повышен, а концентрация ЛГ, как правило, находится в пределах нормы.
Другой причиной орхита является асептический воспалительный процесс на фоне некротизирующего васкулита при облитерирующем эндартериите (болезни Винивартера-Бургера), системных васкулитах и аутоиммунных ревматических болезнях, особенно часто при болезни Бехчета (афты слизистой рта + эрозивно-язвенные поражения гениталий + гипопион радужки + узловатая эритема + тромбозы артериальные и/или венозные + ревматические изменения мягких тканей и суставов + желудочно-кишечные кровотечения + возможные аневризмы аорты и её основных ветвей).
5. Первичный приобретённый гипогонадизм вследствие травматического поражений яичек.
К дегенеративным изменениям в яичках приводят бытовые, военные, спортивные травмы (все виды механического воздействия - ушибы, падения, удары ногой, мячом и т.д.). Особенно тяжелы травмы, сопровождающиеся разрывом белочной оболочки яичка.
Травматические повреждения яичка регистрируются у 5 - 6% всех бесплодных мужчин. Бесплодие при травмах яичка может быть результатом гибели паренхимы травмированного яичка, а также следствием аутоиммунного орхита как травмированного, так и противоположного яичка. Известно, что яичко является органом, изолированным гематотестикулярным барьером, и в обычных условиях не распознается собственной иммунной системой. При повреждении яичка может нарушаться целостность гематотестикулярного барьера и тогда развивается аутоиммунный орхит, приводящий к гипогонадизму. Уровень фолликулостимулирующего и лютеинизирующего гормона бывает часто повышен, особенно при травмах, сопровождающихся разрывом белочной оболочки.
6. Первичный приобретённый гипогонадизм вследствие токсического поражения яичек.
Токсическое поражение яичек под воздействием инфекционной интоксикации (малярийной, туберкулезной, септической, на фоне скарлатины и пневмонии)
Токсическое поражение яичек под воздействием химических агентов, в том числе производственных
Поражение паренхимы яичек может вызываться контактом с промышленными ядами: органическими растворителями, колхицином, бисульфатом, красками, пестицидами, например дибромохлорпропаном.
Пищевые продукты, содержащие глутамат натрия (MSG - Monosodium Glutamate), могут стать причиной серьезных нарушений репродуктивной функции.
Токсическое поражение яичек под воздействием лекарственных препаратов.
Андрогены в дозах, значительно превышающих физиологическиеПротивоэпилептические средстваАнаболические стероидыСнотворные препаратыЭстрогеныАнтагонисты Н2-рецепторовАгонисты и антагонисты гонадотропинрилизинг гормонаНейролептикиГлюкокортикоиды в дозах, значительно превышающих физиологическиеАнтидепрессантыПрепараты тиреоидных гормонов в дозах, значительно превышающих физиологическиеАнтагонисты дофаминаАнтиандрогенные препаратыПротивоопухолевые препаратыИнгибиторы 5 альфа - редуктазыАльфа и бета - адреноблокаторыБлокаторы стероидогенезаПротивотуберкулезные препаратыГиполипидемические препаратыНаркотические средства К первичному приобретенному гипогонадизму могут привести некоторые лечебные манипуляции, например, медикаментозная кастрация по поводу рака предстательной железы.Химиотерапия рака обладает дозозависимым эффектом на герминогенный эпителий. В период предшествующий половому созреванию зачатковый эпителий яичек более устойчив к токсическому воздействию лекарств, чем во взрослом возрасте. Алкилирующие препараты, применяемые в химиотерапии, такие как хиромантин, циклофосфамид обладают токсическим повреждающим действием на яички. Так, прием циклофосфамида, бисульфана, винбластина часто приводит к азооспермии. При этом тестикулярная биопсия показывает полное исчезновение всех клеток сперматогенеза, включая сперматогонии, что определяется как синдром клеток Сертоли.Антилейкемические препараты так же вызывают олигозооспермиюТоксическое воздействие на сперматогенез оказывают некоторые антибиотики - тетрациклин, гентамицин, эритромицин. Нитрофураны (фурадонин, фурагин) угнетают сперматогенез, снижают подвижность сперматозоидов.Прием антималярийных препаратов может являться причиной бесплодия.Преднизолон, кетоконазол, гидрокортизон, дексаметазон, синестрол резко угнетают андрогенную функцию яичек и отрицательно влияют на сперматогенез на уровне сперматогоний и сперматид.
Циметидин - антагонист тестостерона блокирует периферическое действие тестостерона в тканях-мишенях. Частые побочные эффекты - гинекомастия и снижение количества сперматозоидов.Токсическое поражениепод воздействием бытовых интоксикаций.Алкогольные поражения яичек.Клинические и лабораторные признаки гипогонадизма наблюдаются при хроническом алкоголизме. Установлено прямое токсическое действие алкоголя на паренхиму яичек, в результате которого возникают нарушения сперматогенеза, ведущие к появлению в семенной жидкости патологически измененных сперматозоидов. У таких пациентов обнаружено не только уменьшение числа, но и появление в семенной жидкости большого количества биологически неполноценных сперматозоидов, что характеризуется увеличением неподвижных форм и морфологически неполноценных сперматозоидов, появлением в эякуляте молодых клеток. Все это свидетельствует о торможении сперматогенеза на стадии сперматид.
Наркотические поражения яичек.Наркотические препараты, такие как марихуана, героин, метадон приводят к более низкому уровню тестостерона в плазме без сопутствующего повышения уровня ЛГ. Это указывает как на нарушения центрального генеза, так и нарушения на уровне яичек.Героин подавляет либидо у мужчин и женщин и угнетает сперматогенез, вызывая токсическое бесплодие. Результатом такого токсического действия оказывается хорошо известное наркоманам-мужчинам уменьшение размеров полового члена, а также длительная боль и припухлость в области яичек. 7. Первичный приобретённый гипогонадизм вследствие воздействия проникающей радиации.Ткани паренхимы яичка по-разному переносят радиацию. Клетки сперматогенеза очень чувствительны к облучению, в то время как клетки Лейдига относительно устойчивы. Если доза была не слишком высока, то сперматогенез восстанавливается. Облучение в дозе менее 600 рад приводит к обратимому повреждению клеток яичек. Восстановление сперматогенеза может занять 2-3 года даже у мужчин, подвергшимся низким дозам облучения. Повышенный уровень ФСГ отражает ослабление сперматогенеза. При восстановлении функции яичка уровни ФСГ возвращаются к норме.При более высоких уровнях облучения более вероятно возникновение стойких нарушений. При больших дозах повреждаются семенные канальцы, и концентрация ФСГ плазмы крови увеличивается уже постоянно. Клетки Лейдига достаточно резистентны к радиоактивному облучению, поэтому уровни ЛГ и тестостерона остаются нормальными. 8. Первичный приобретённый гипогонадизм вследствие патологии внутренних органов. Заболевание Клинические и лабораторные проявленияХроническая печеночная недостаточностьГинекомастия, уменьшение вторичного оволосения, снижение либидо, эректильная дисфункция и другие симптомы гипогонадизма; снижение уровня тестостерона, повышение уровня лютеинизирующего и фолликулостимулирующего гормонов, секс стероидсвязывающего глобулина, эстрадиола; нарушение сперматогенезаХроническая почечная недостаточностьКлиника гипогонадизма может быть умеренно выражена; сниженный уровень тестостерона, повышенный уровень лютеинизирующего и фолликулостимулирующего гормонов.Сахарный диабетЭректильная дисфункция, нормальное либидо (в большинстве случаев); сниженный уровень тестостерона, секс стероидсвязывающего глобулина, лютеинизирующего и фолликулостимулирующего гормонов.Хроническая анемияСниженный уровень тестостерона, лютеинизирующего и фолликулостимулирующего гормонов.ГемохроматозТипичная клиника гипогонадизма; снижение уровней тестостерона, лютеинизирующего и фолликулостимулирующего гормонов, нормальный сперматогенезТиреотоксикозСнижение либидо, эректильная дисфункция, гинекомастия; повышенный уровень общего тестостерона, секс стероидсвязывающего глобулина, эстрадиола, лютеинизирующего и фолликулостимулирующего гормонов, сниженный уровень свободного тестостеронаГипотиреозСнижение либидо, эректильная дисфункция; сниженный уровень тестостерона, секс стероидсвязывающего глобулина; часто - повышенный уровень пролактинаСиндром КушингаГинекомастия, снижение либидо, эректильная дисфункция; сниженный уровень тестостерона, эстрадиола, лютеинизирующего и фолликулостимулирующего гормонов, секс стероидсвязывающего глобулина; нарушение сперматогенезаОжирениеГинекомастия, снижение либидо, эректильная дисфункция; сниженный уровень тестостерона, секс стероид, связывающий глобулина, повышенный уровень эстрадиола, нормальный или сниженный уровень лютеинизирующего и фолликулостимулирующего гормонов.Заболевания спинного мозгаИногда - гинекомастия; нарушение эякуляции, эректильная дисфункция; нормальный уровень тестостерона, лютеинизирующего и фолликулостимулирующего гормонов, эстрадиола; олигозооспермия, азооспермия, некроспермияВИЧ-инфекцияГинекомастия, снижение либидо; сниженный уровень тестостерона, лютеинизирующего и фолликулостимулирующего гормонов; нарушение сперматогенезаЗлокачественные опухолиСниженный уровень тестостерона, повышенный уровень секс стероидсвязывающего глобулина и пролактина; олигоспермия.Экстремальные состояния, стрессСниженный уровень тестостерона, лютеинизирующего и фолликулостимулирующего гормонов, нарушение сперматогенезаПоражение яичек при хронической почечной недостаточности.Такие системные заболевания, как почечная недостаточность, сопровождаются у мужчин возникновением гипогонадизма, снижением либидо, потенции, нарушением сперматогенеза и гинекомастией. Уровни ЛГ и ФСГ повышены, а уровень тестостерона снижен. Причина развития гипогонадизма при уремии многофакторная. У каждого четвертого пациента с уремией обнаруживается повышение уровня пролактина. Дополнительный вклад может вносить избыток эстрогенов. Прием гипотензивных лекарственных средств, уремическая нейропатия также могут играть роль в развитии гипогонадизма. После удачной трансплантации почки течение уремического гипогонадизма улучшаетсяПоражение яичек при хронической печеночной недостаточности.У большого процента мужчин с циррозом печени наблюдается атрофия яичек, импотенция и гинекомастия. Уровень тестостерона снижен, а уровень эстрадиола повышен вследствие одновременного уменьшения синтеза андрогенов в печени и увеличения периферической конверсии в эстрогены. При относительно низком уровне тестостерона сыворотки крови отмечается умеренное повышение ЛГ и ФСГ.Поражение яичек при сахарном диабете.Распространенность гипогонадизма при инсулиннезависимом сахарном диабет достигает 30-75%. Наличие гипогонадизма у больных инсулиннезависимым диабетом ухудшает состояние углеводного обмена, способствует нарушению метаболизма липидов, приводит к расстройствам психо-эмоционального статуса и половой функции. Все это снижает качество жизни больных, и уменьшают психологическую мотивацию к его компенсации 9. Первичный приобретённый гипогонадизм вследствие воздействия факторов окружающей среды.Высокая температура окружающей среды нарушает нормальный синтез и обмен половых гормонов, что отражается как на репродуктивной, так и на половой функции.
Общая вибрация также отрицательно сказывается на сперматогенезе.Неблагоприятное воздействие на яички оказывают переменные токи высокой частоты. Существенно влияют на организм и электромагнитные поля, пребывание в зоне которых нарушает суточный ритм функционирования регуляторных систем человеческого организма, в частности функцию гипоталамуса. В патогенезе половых расстройств в результате вредных физических профессиональных воздействий существенную роль играют нарушения вегетативной нервной системы, изменение секреции и биосинтеза катехоламинов. 10. Первичный приобретённый гипогонадизм вследствие нарушений кровообращения в яичках при хирургической патологии.Широко известен случай Уардлопа, когда аневризма брюшной аортыпривела к сдавлению яичковых артерий с обеих сторон и к полной атрофии обоих яичек.Операции на паховом канала по поводу паховой грыжи могут осложняться пересечением или сдавлением семенной артерии с последующей атрофией яичка. Операции на органах мошонки, например, орхопексия при крипторхизме, при небрежном отношении к сосудам яичек, могут осложниться нарушением питания и атрофией яичекДвухсторонний перекрут семенных канатиков и заворот яичек сопровождается нарушением кровообращения, и при несвоевременном лечении атрофией яичек.При двухсторонней водянке оболочек яичек может развиться гипогонадизм. Наиболее частой причиной гидроцеле является травма, которая обыкновенно настолько незначительна, что не обращает на себя внимания. Через 2-3 недели после травмы в одной из половин мошонки возникает безболезненная опухоль, которая медленно увеличивается. По мере увеличения гидроцеле, может возникать болевой синдром. Гидроцеле может наблюдаться как осложнение трансплантации почки вследствие пересечения семенного канатика. До начала XX века наиболее частой причиной водянки оболочек яичек был гонорейный эпидидимит. После эпидидимита водянка появляется еще позже, чем после травмы, через много недель, иногда даже месяцев. И все же во многих случаях причины возникновения гидроцеле остаются неясными.Прямой причиной возникновения гидроцеле является дисбаланс между секреторной или адсорбционной способностью влагалищной оболочки яичка. Это положение принято и в настоящее время. Появление гидроцеле после варикоцелектомии - достаточно частое явление. Это объясняется тем, что во время операции Иваниссевича пересекаются лимфатические сосуды, сопровождающие яичковую вену. Возникающий вследствие этого лимфостаз и служит причиной возникновения гидроцеле.При варикоцеле гипотрофия левого яичка встречается часто, однако атрофия обоих яичек - явление чрезвычайно редкое. Еще Хольцов Б.Н. 1927г указывал, что «болезнь совершенно безопасна для жизни».Варикоцеле является наиболее часто распознаваемой причиной мужского бесплодия, оно встречается примерно у 15 % всех мужчин и примерно у 40 % мужчин с бесплодием.Иногда при двухстороннем варикоцеле развивается гипотрофия яичек с клиническими и лабораторными признаками гипогонадизма. Чаще всего это встречается уже в возрасте после 35 лет.С другой стороны, атрофия яичка после варикоцелектомии является одним из нередких осложнений операции, особенно после операции Коха.11. Первичный приобретённый гипогонадизм вследствие нарушения иннервации яичка. Заболевания спинного мозга на уровне пояснично-кресцового отдела позвоночника и конуса, а также при поражении нервных корешков конского хвоста и при периферических полиневропатиях с поражением срамного нерва иногда сопровождаются нарушениями иннервации органов мошонки и яичек, что в тяжелых случаях приводит к их атрофии и развитию гипогонадизма. Подобное состояние также возникает после двухсторонней симпатэктомии по поводу облитерирующих заболеваниях нижних конечностей и болезни Рейно. 12. Первичный приобретённый гипогонадизм вследствие феминизирующих карцином.У мужчин феминизирующая карцинома чаще всего локализуется яичках, коре надпочечников, иногда в печени (особенно при чрезмерном использовании стероидных гормонов). Феминизирующие эстрогенпродуцирующие опухоли проявляются, прежде всего, развитием гинекомастии, атрофией яичек и потерей либидо. Эти опухоли продуцируют большое количество эстрогенов, которые подавляют действие мужского полового гормона и оказывают токсическое действие на спермообразующую и гормонпродуцирующую функцию яичек. Кроме того, надпочечниковые опухоли секретируют чрезмерные количества андростендиона, который на периферии превращается в эстрон и эстрадиол. Лечение исключительно хирургическое. Вторичный гипогонадизм. В регуляции функции яичек участвуют кора головного мозга, подкорковые структуры, гипоталамус, гипофиз, а также сами эндокринные и половые клетки яичек. Система регуляции включает несколько петель отрицательной обратной связи. Гипоталамус секретирует гонадолиберин - стимулятор секреции лютеинизирующего и фолликулостимулирующего гормона в аденогипофизе. Секреция гонадолиберина контролируется множеством нервных и гуморальных сигналов, которые интегрируются гипоталамусом. Нейроны гипоталамуса секретируют гонадолиберин в воротную систему гипофиза не непрерывно, а импульсно. Именно импульсное воздействие гонадолиберина на гонадотропные клетки стимулирует секрецию лютеинизирующего и фолликулостимулирующего гормона. Напротив, непрерывное воздействие гонадолиберина приводит к десенситизации его рецепторов на гонадотропных клетках и к подавлению секреции лютеинизирующего и фолликулостимулирующего гормона.Вышележащие отделы ЦНС, в том числе кора и лимбическая система, могут, как стимулировать, так и подавлять секрецию гонадолиберина. Тестостерон, дигидротестостерон и эстрадиол подавляют секрецию гонадолиберина по принципу отрицательной обратной связи. Норадреналин стимулирует, а дофамин и эндорфины подавляют секрецию гонадолиберина. Мелатонин регулирует суточный и сезонный ритм секреции гонадолиберина.Гипофиз секретирует лютеинизирующий и фолликулостимулирующий гормон, а также пролактин. Лютеинизирующий гормон действует в первую очередь на клетки Лейдига. Связывание лютеинизирующего гормона с мембранными рецепторами активирует аденилатциклазу. Повышение уровня цАМФ в клетках Лейдига ускоряет метаболизм холестерина. В результате увеличивается содержание субстратов стероидогенеза и синтез половых гормонов ускоряется.Фолликулостимулирующий гормон действует преимущественно на клетки Сертоли. Действие фолликулостимулирующего гормона также опосредуется аденилатциклазой. Накопление цАМФ активирует протеинкиназу A. В результате усиливается синтез белков, в том числе - андрогенсвязывающего белка, ингибина, активина, тканевого активатора плазминогена, гамма-глутамилтрансферазы и ингибитора протеинкиназы. Первые три белка секретируются в просвет извитых семенных канальцев и участвуют в сперматогенезе. Роль остальных белков пока не выяснена. Фолликулостимулирующий гормон не влияет на стероидогенез в клетках Лейдига, но стимулирует их дифференцировку и тем самым косвенно усиливает продукцию тестостерона. Кроме того, фолликулостимулирующий гормон стимулирует созревание сперматозоидов.У взрослых секреция лютеинизирующего и фолликулостимулирующего гормона так же, как и секреция гонадолиберина, имеет импульсный характер. Соотношение уровней лютеинизирующего и фолликулостимулирующего гормона в крови зависит от частоты выбросов гонадолиберина. Уровни лютеинизирующего и фолликулостимулирующего гормона регулируются не только гонадолиберином. По принципу отрицательной обратной связи секреция лютеинизирующего гормона подавляется тестостероном, дигидротестостероном и эстрадиолом, а секреция фолликулостимулирующего гормона - ингибином.Вторичный гипогонадизм- это дисфункция гипоталамо-гипофизарной системы, при которой вторичная тестикулярная недостаточность развивается вследствие отсутствия адекватной стимуляции яичек гонадотропными гормонами гипофиза или вследствие токсического воздействия на половую систему избыточно синтезируемого пролактина. Характерными биохимическими признаками вторичного гипогонадизма являются низкий уровень тестостерона в сыворотке крови в сочетании с пониженным уровнем лютеинизирующего и фолликулостимулирующего гормона.Гипогонадизм в сочетании с аносмией или несахарным диабетом указывает на патологию гипоталамуса, а в сочетании с дефектами полей зрения - на патологию гипофиза. Классификация вторичного гипогонадизма. I. Гипогонадотропный гипогонадизм. А. Врождённый гипогонадотропный гипогонадизм.
- изолированный (идиопатический) гипогонадизм
- изолированный дефицит лютеинизирующего гормона
- Изолированный дефицит фолликулостимулирующего гормона
- Синдром Каллмена (ольфактогенитальный синдром)
- Гипофизарный нанизм (гипофизарная карликовость, микросомия)
- Первичный гипопитуитаризм.
- Синдром Прадера-Вилли
- Синдром Лоренса - Муна - Барде - Бидля
- Редкие формы врожденного гипогонадотропного гипогонадизма
В. Приобретённый гипогонадотропный гипогонадизм.
- Адипозогенитальная дистрофия (болезнь Перхкранца - Бабинского - Фрелиха)
- Вторичный гипопитуитаризм.
II. Нормогонадотропный гипогонадизм или гиперпролактинемический синдром. Врождённый гипогонадотропный гипогонадизм. Врожденный гипогонадотропный гипогонадизм у мужчин возникает вследствие врожденного отсутствия адекватной стимуляции гормонпродуцирующей и спермообразующей функции яичек со стороны гипоталамуса и гипофиза, расположенных в головном мозге. В большинстве случаев выпадение гонадотропной функций гипофиза сочетается с другими пороками развития. Причиной нарушения гонадотропной функции является целлюлярная недостаточность самого гипофиза или гипоталамическая недостаточность с выпадением образования гонадотропин-рилизинг гормона. Изолированный (идиопатический) гипогонадизм. Это единственная форма гипогонадизма, при которой поражена только половая система. Протекает в форме тотального дефицита гонадотропных гормонов.Причина данного заболевания окончательно не выяснена. Наследственная предрасположенность наблюдается крайне редко.Чаще в анамнезе осложненная беременность у матери - ранние и поздние токсикозы беременности, контакт с химическими вредными веществами, прием во время беременности эстрогенов и больших доз прогестерона. Определенная роль отводится тяжелым родам с асфиксией плода. Анализ всех данных позволяет предполагать вероятным внутриутробное происхождение идиопатического гипогонадотропного гипогонадизма.Тотальный дефицит лютеинизирующего и фолликулостимулирующего гормона связан с повреждением гипоталамуса, поскольку проба с антиэстрогенным препаратом кломифеном при данной патологии всегда отрицательная.Проба с гонадолиберином позволяет отдифференцировать причину идиопатического гипогонадотропного гипогонадизма. При этой патологии проба с гонадолиберином положительная, т. е клетки гипофиза отвечают повышением продукции лютеинизирующего и фолликулостимулирующего гормона в ответ на стимуляцию гонадотропин-рилизинг гормоном. Исходя из результатов обеих проб можно сделать вывод, что причина идиопатического гипогонадотропного гипогонадизма кроется в недостаточности гипоталамуса. Хроническое состояние дефицита гонадотропинов вызывает снижение продукции тестостерона яичками, однако не нарушает в них метаболизм тестостерона. В яичках сохраняются резервы синтеза андрогенов, что проявляется повышением концентрации тестостерона в крови при длительной стимуляции клеток Лейдига хорионическим гонадотропином. При однократном введении хорионического гонадотропина в дозе2000 Ед. клетки Лейдига на стимуляцию не отвечают, по видимому, в связи со сниженной концентрации на них рецепторов лютеинизирующего гормона.При идиопатическом гипогонадотропном гипогонадизме не выявлено существенных морфологических изменений в гипоталамо-гипофизарной области, как нет и клинических признаков нарушения центральной нервной системы, в отличие от других форм гипогонадотропного гипогонадизма, возникающих на фоне грубых изменений гипоталамуса, гипофиза и межуточного мозга. В биоптатах яичек выявляется большое количество семенных канальцев, выстланных незрелыми клетками Сертоли и сперматогониями, редко обнаруживаются первичные сперматоциты.
Идиопатический гипогонадотропный гипогонадизм до пубертатного возраста проявляет себя выраженным гипогенитализмом: половой член гипоплазирован, часто наблюдаются крипторхизм, сами яички малых размеров, мягкие и слабо чувствительные при пальпации. Для детей до 16 лет характерно формирование евнухоидной внешности (усиленный рост за счет нижних конечностей), полное отсутствие вторичных половых признаков даже в 16 лет, отложение жира по женскому типу с признаками ложной гинекомастии с феминизацией фигуры, задержка сексуального развития.У взрослых практически отсутствуют эрекции, никогда не бывает поллюций, наблюдаются аспермия и внегенитальные признаки гипоандрогении: вегетососудистая дистония, головные боли, утомляемость, снижение работоспособности, варикозное расширение вен нижних конечностей.
Классический тотальный гипогонадотропный гипогонадизм имеет общие признаки с синдромом анорхизма: черты евнухоидизма, внегенитальные признаки гипоандрогенизации, отсутствие клинически выраженных признаков нарушения ЦНС, астенизация, вегетососудистая дистония без соматических расстройств, сходные психологические и поведенческие черты.Лечение идиопатического гипогонадотропного гипогонадизма проводят хорионическим гонадотропином по 1500-2000 Ед. внутримышечно 2 раза в неделю по месяцу, с месячными перерывами в течение всего репродуктивного периода. При этом полезно применение андрогенов. Именно лечение хорионическим гонадотропином после 12-24 месяцев терапии приводило к положительному эффекту с появлением сперматозоидов у пациентов с азооспермией. В то же время применение препаратов тестостерона, даже в сочетании с менопаузным гонадотропином, лечебного эффекта не вызывало. Изолированный дефицит лютеинизирующего гормона (синдром Паскуалини, синдром «фертильного евнуха»). Кариотип 46ХY. Это врожденное заболевание, характеризующееся избирательной недостаточностью выработки лютеинизирующего гормона клетками гипофиза, в результате чего синтез тестостерона в яичках минимальный, что приводит к андрогенной недостаточности.Клинические признаки аналогичны картине идиопатического гипогонадотропного гипогонадизма. Выраженность симптоматики зависит от степени снижения лютеинизирующего гормона и выраженности андрогенной недостаточности. Изолированный дефицит лютеинизирующего гормона проявляется высоким ростом, евнухоидными пропорциями тела, малым половым членом, скудным половым оволосением, нарушением сексуальной функции.Уровень лютеинизирующего гормона в крови низкий, уровень фолликулостимулирующего гормона - в пределах нормы. У пациентов с этой патологией проба с кломифенцитратом приводит к значительному увеличению уровня ФСГ в крови, а уровень лютеинизирующего гормона остается низким. Причиной такой избирательной недостаточности является неполноценность клеток гипофиза, продуцирующих лютеинизирующий гормон. Проба с гонадолиберином также подтверждает избирательную неспособность поврежденных клеток гипофиза реагировать на стимуляцию гонадотропин-рилизинг гормоном. При проведении пробы концентрация ФСГ в крови увеличивается, а уровень лютеинизирующего гормона остается прежним.По спермограмме выявляются олигозооспермия, нарушение подвижности сперматозоидов, уменьшение фруктозы. Пациенты способны иметь детей, хотя иногда обращаются к врачу в связи с бесплодием, которое зависит от дефицита андрогенов, провоцирующих гипоспермию.Лечение синдрома Паскуалини медикаментозное. Назначается хорионический человеческий гонадотропин курсами по одному месяцу с месячным перерывом на протяжении всего репродуктивного периода. Изолированный дефицит фолликулостимулирующего гормона. При изолированном дефиците фолликулостимулирующего гормона отмечается нормально развитый половой член, хорошо выраженные вторичные половые признаки, нормальная потенция, слегка гипоплазированные яички, олиго - или азооспермия. Но у пациентов с этой формой нарушения менее выражены евнухоидные пропорции тела, и половой член развит лучше, чем при вышеописанных формах гипогонадизма, яички плотные и нечувствительные к пальпации, с опозданием, но появляется скудное оволосение. В связи с сохраненной половой функции и обычной внешностью больные редко обращаются к врачу, не считая себя виновными в бесплодном браке.
Уровень фолликулостимулирующего гормона снижен, лютеинизирующий гормон в норме. У пациентов с изолированным дефицитом фолликулостимулирующего гормона проба с антиэстрогенными препаратами приводит к увеличению концентрации лютеинизирующего гормона, что подтверждает парциальную неполноценность клеток гипофиза, продуцирующих именно фолликулостимулирующий гормон. Проба с гонадолиберином избирательно отрицательная, т.е. после стимуляции избирательно повышается только лютеинизирующий гормон, что опять таки свидетельствует о неспособности поврежденных клеток гипофиза реагировать на стимуляцию гонадолиберином.
При изолированном дефиците фолликулостимулирующего гормона даже курсовая стимуляция хорионическим гонадотропином (3-5 дней) не увеличивает концентрацию тестостерона в крови, что может свидетельствовать о скрытом дефиците его синтеза. Этот феномен дает некоторое сходство с анорхизмом, при котором проба с хорионическим гонадотропином также отрицательная. В дифференциальной диагностике помогает проба с менопаузным гонадотропином, который обладает активностью ФСГ и при совместном его применении с хорионическим гонадотропином увеличивает концентрацию тестостерона в крови.
Дефицит ФСГ неблагоприятно влияет на состояние интерстициальных эндокриноцитов, обусловливая, хотя и позднюю, клинику андрогенной недостаточности и лишний раз свидетельствуя о синергическом действии обоих гонадотропных гормонов. Синдром Каллмена (ольфактогенитальный синдром). Кариотип 46XY. Синдром Кальмана встречается в виде спорадических и семейных случаев. Анализ более 120 случаев заболевания (R.Whitcomb и W. Crowley, 1990) показывает, что чаще отмечаются спорадические случаи заболевания. Тем не менее, в семейных наблюдениях прослеживается аутосомно-доминантный путь наследования. Характеризуется недостаточностью лютеинизирующего и фолликулостимулирующего гормона и снижением или отсутствием обоняния (аносмией или гипосмией). Иногда передается не весь симптомокомплекс, а часть признаков.
При введении гонадолиберина наблюдается повышение лютеинизирующего и фолликулостимулирующего гормона, что указывает на первичную патологию гипоталамических центров и интактный гипофиз. Установлено, что у эмбриона нейроны обонятельного нерва и нейроны, секретирующие гонадолиберин, закладываются в области гайморовой пазухи верхней челюсти. Затем они мигрируют вверх, и первые достигают области луковицы обонятельного нерва, а вторые - области гипоталамуса. Понятно, почему при синдроме Каллмена имеет место сочетание нарушения обоняния и секреции гонадолиберина. Синдром Каллмена характеризуется дефектом миграции этих двух типов нейрональных клеток. У больных с синдромом Каллмена выявлена делеция так называемого KALIG-1 гена, который локализуется на хромосоме Хр22. Этот ген "ускользает" от инактивации на Х хромосоме и имеет гомолог на Y хромосоме.Дефицит гонадотропных гормонов вторично вызывает тестикулярную недостаточность с клиническими проявлениями андрогенной недостаточности и бесплодия. У пациентов резко уменьшены яички и они мягкие, формируется евнухоидная внешность (высокий рост, удлиненные нижние конечности), малый половой член, полное отсутствие вторичных половых признаков. Симптомы нарушения обоняния связаны с кистозным дефектом обонятельного центра и неправильным формированием обонятельных нервных окончаний. У части больных наблюдаются также снижение слуха (до полной глухоты) и другие врожденные дефекты ("заячья губа", "волчья пасть", высокое "готическое" небо, укорочение уздечки языка, асимметрия лица, шестипалость).По данным гормонального исследования выявляется низкая концентрация в крови лютеинизирующего и фолликулостимулирующего гормона и тестостерона. Проба с хорионическим гонадотропином, а также сочетания хорионического с менопаузным гонадотропином положительная.
Лечение патологии состоит в длительном (на протяжении многих лет) применении хорионического гонадотропина по 1500-2000 Ед. 2 раза в неделю один месяц 6 курсов в год с перерывами по месяцу. При выраженной гипоплазии яичек и андрогенной недостаточности рекомендуется дополнительно использовать андрогены пролонгированного действия. В результате возможно появление вторичных половых признаков и даже способности к оплодотворению. Введение гонадотропинов с помощью дозаторов пульсирующим способом дает еще более хороший эффект.
Учитывая, что при синдроме Каллмена первично нарушены синтез и секреция гонадолиберина, можно ожидать эффекта от терапии этим гормоном. Однако первые попытки лечения таких больных гонадолиберином оказались неутешительными из-за пониженного ответа тестикулярной ткани, что не исключает и патологию рецепторов. Гипофизарный нанизм (гипофизарная карликовость, микросомия). Это заболевание характеризуется карликовым ростом у мужчин - до 130 см.Развивается в результате генетического дефекта синтеза соматотропина, а также как исход патологических процессов в гипоталамо-гипофизарной области (сосудистые, опухолевые заболевания, интоксикации) или родовой травмы с поражением этой области.
В патологический процесс вовлекаются и соседние участки аденогипофиза. В результате наблюдается резкое снижение соматотропного, лютеинизирующего, фолликулостимулирующего, тиреотропного и адренокортикотропного гормона, что и определяет соответствующую клиническую симптоматику вследствие вторичного нарушения функции яичек, щитовидной железы и надпочечников.
В результате указанных причин страдают в первую очередь структуры гипофиза, продуцирующие соматотропный гормон или область гипоталамуса, вырабатывающая и секретирующая рилизинг-гормоны. Недостаток СТГ ведет к задержке роста скелета, его возрастной дифференцировки, к микросомии. При гистологическом исследовании выявляются дистрофические процессы в аденогипофизе, гипопластические изменения в яичках, щитовидной железе, коре надпочечников, явления микросомии, позднее окостенение эпифизарных хрящей, запоздалое появление центров окостенения.
Задержка роста становится явной в 2-5 лет. Нанизм констатируется только при отставании в росте в среднем на 20-25% от возрастной нормы. Сохраняется пропорциональное телосложение, все органы имеют соответственно малые размеры. Дифференциация скелета отстает на 5-10 лет. Наибольшее отставание костного возраста от паспортного возникает в возрасте 17-20 лет.
Помимо отставания в росте для всех мужчин характерна недостаточность сексуальных признаков - малый половой член, гипоплазированная мошонка и яички, одно- или двусторонний крипторхизм. Кожа у пациентов тонкая и бледная, волосы редкие и тонкие, характерный облик с мелкими чертами лица, неразвитая нижняя челюсть. Пациенты имеют высокий голос, отложение жира по женскому типу, отсутствуют сексуальные реакции - поллюции, эрекции и половое влечение отсутствуют; бесплодие в связи с азооспермией. Интеллект не нарушен.
При лабораторных исследованиях выявляется сниженный уровень соматотропного, лютеинизирующего, фолликулостимулирующего, тиреотропного и адренокортикотропного гормона и лабораторных показателей функций яичек, щитовидной железы, коры надпочечников. Рентгенологически - уменьшено турецкое седло, задержано окостенение эпифизов костей, открыты зоны роста, в том числе и у взрослых.
Лечение гипофизарного нанизма проводится человеческим соматотропным гормоном, анаболическими препаратами, тиреоидином. С целью стимуляции полового развития применяется хорионический гонадотропин по 1000-1500 Ед. внутримышечно 2 раза в неделю месячными курсами с месячными перерывами в течение многих лет. После курсов хорионического гонадотропина назначают препараты тестостерона. При нарушении функции центральной нервной системы - церебролизин, липоцеребрин, глутаминовую кислоту.
Если в основе гипофизарного нанизма нет онкологической патологии, прогноз жизни благоприятен.
Дифференциальная диагностика различных форм нанизма.
Примордиальная (здоровая первичная карликовость): Рождаются карликами, костный возраст совпадает с паспортным, умственное развитие нормальное, половое созревание наступает своевременно. Функция эндокринных желез в нормеБолезнь Дауна (монголоидная карликовость): Характерный внешний вид: раскосые глаза, бессмысленное выражение лица, дебильность; пороки развития.Тиреогенный нанизм (кретинизм): Симптомы микседемы, снижение интеллекта, резкое уменьшение уровня тироксина в кровиСиндром Шерешевского - Тернера: Характерный внешний вид: короткая шея с крыловидными складками, пороки развития внутренних органов, полидактилия, гипогенитализм.Хондродистрофия: Непропорционально короткие конечности при нормальном развитии скелета, туловища и головы, нормальном половом развитииСиндром Мориака: Сочетание декомпепсированного сахарного диабета, гепатомегалии, инфантилизмаСоматогенный нанизм: Хронические заболевания сердца, почек, легких, пищеварительной системы Синдром Прадера-Вилли. Синдром Прадера-Вилли- врожденное заболевание, при котором возникает сочетание ожирения, низкого роста, гипогонадизма и низкого интеллекта. R. Pauli и соавт. (1983) у мальчика с синдромом Прадера-Вилли выявили делецию в области 15q хромосомы. Причем нарушения 15-й хромосомы выявлены у 50% (20 из 40) обследованных больных с этим синдромом (D. Ledbetter и соавт.,1982). Гипогонадотропный гипогонадизм вызывается конституциональной недостаточностью гонадотропин-рилизинг гормона гипоталамуса, и как следствием, недостаточной стимуляцией гонадотропной функции гипофиза.Ребенок с синдромом Прадера-Вилли рождается с низкой массой тела и низким ростом. На первом году жизни у ребенка выраженная гипотония мышц. Суставы могут быть переразогнуты из-за гипотонии, и ребенок может иметь причудливую осанку, когда начинает ходить. Ожирение начинается позднее к 2-4 году жизни в связи с повышенным аппетитом. Ребенок очень много ест не насыщаясь. Вскоре становится заметным отставание в психическом развитии. Больные имеют низкий лоб, речь их монотонна. Обычно такие пациенты добродушны и дружелюбны, но у них бывают вспышки агрессии. Заподозрить это заболевание иногда возможно во внутриутробном периоде при ультразвуковом исследовании, если плод слабоподвижен или вовсе не двигается. Многие пациенты рождаются с крипторхизмом.У всех больных с синдромом Прадера-Виллинаблюдается снижение в крови количества тестостерона и гонадотропных гормонов.Лечениебольных синдромом Прадера-Вилли медикаментозное. Назначается заместительная терапия хорионическим гонадотропином. Для коррекции повышенного веса применяется диета. Синдром Лоренса - Муна - Барде - Бидля. Синдром описан в 1866 г. Лоренсом и Муном, как сочетание пигментной дистрофии сетчатки с гипогонадизмом, ожирением и умственной отсталостью, а в 1920 г. - Барде и Бидлем, но с добавлением к указанному симптомокомплексу полидактилии. Зафиксировано немногим более 500 больных. Популяционная частота в Европе среди новорожденных невысокая 1: 160 000.Заболевание имеет наследственную природу с аутосомно-рецессивным типом наследования. Гипогонадотропный гипогонадизм, также как и при синдроме Прадера-Вилли, вызывается конституциональной недостаточностью гонадотропин-рилизинг гормона гипоталамуса, и как следствием, недостаточной стимуляцией гонадотропной функции гипофиза.Синдром Лоренса - Муна - Барде - Бидля характеризуется большой вариабельностью проявлений. Чаще наблюдается 3 или 4 признака (неполная форма), реже - пять (полная форма). Из основных симптомов наиболее часто встречаются пигментный ретинит и другие изменения сетчатки (93%), ожирение (90%) и умственная отсталость (87%); полидактилия обнаруживается у 60-70% больных.Гипогонадизм проявляется гипоплазией наружных половых органов, крипторхизмом, эректильной дисфункцией, возможны также гинекомастия, недостаточный рост волос на лице, в подмышечных ямках, на лобке. При гистологическом исследовании яичек обнаруживаются перитубулярный фиброз, связанный с утолщением базальной мембраны, уменьшение числа сперматогониев, гиалиноз канальцев.Часто наблюдаются дефекты развития почек. Спектр поражения почек широко варьирует: гипоплазия, кортикальные и медуллярные кисты, различные формы дисплазий, перигломерулярный и интерстициальный фиброз, пролиферация мезангия.Пигментная дегенерация сетчатки проявляется к 6-7 годам снижением зрения и с возрастом неуклонно прогрессирует. Возможна и другая патология зрения - макулярная дегенерация, катаракта, миопия, атрофия зрительных нервов, микрофтальмия, отсутствие всей радужки или большей ее части - аниридия. К 30 годам большинство больных практически полностью слепнут.
Ожирение проявляется на 1-2-м году жизни, быстро прогрессирует, достигая III-IV степени.
У большинства больных отмечается умственная отсталость от легкой дебильности до идиотии. У лиц с полной формой заболевания чаще имеется глубокая умственная отсталость - имбецильность или идиотия, а при неполных формах - лишь легкие нарушения познавательных функций. В то же время при этом синдроме не исключен и нормальный интеллект. Признаки органического поражения центральной нервной системы проявляются инертностью психических процессов, выраженной астенией в сочетании с головными болями, головокружениями, ухудшением памяти, иногда возникают судороги, возможны экстрапирамидные расстройства.
При неполных формах синдрома может возникнуть необходимость в дифференциальной диагностике с синдромом Альстрема, для которого также характерны пигментная дегенерация сетчатки, ожирение, поражение почек, но, кроме того, имеется сахарный диабет. Необходима также дифференциальная диагностика с адипозогенитальной дистрофией, для которой характерны ожирение и гипогонадизм, но отсутствуют полидактилия, олигофрения и пигментная дегенерация сетчатки.Ожирение корригируют назначением диеты. Полидактилию устраняют оперативным путем. Разработаны методы предупреждения прогрессирования снижения зрения вследствие пигментной дегенерации сетчатки.
Вероятность повторного рождения больного ребенка в семье составляет 25%, что относится к категории высокого генетического риска. При планировании деторождения в семье, где уже есть больной ребенок, необходимо медико-генетическое консультирование.
Прогноз неблагоприятный. Чаще больные погибают в возрасте 10-20 лет. Причиной смерти является уремия или интеркуррентное заболевание. Редкие формы врожденного гипогонадотропного гипогонадизма Синдром Мэддока. Проявляется недостаточностью гонадотропной и адренокортикотропной функций гипофиза. Этиология неизвестна.При этом синдроме постепенно нарастает недостаточность коры надпочечников, вследствие недостаточности стимулирующего действия гипофизарного адренокортикотропного гормона. Кроме того, после прохождения пубертатного периода констатируется недостаточность функции мужских половых желез - развивается евнухоидизм, гипогенитализм, половая слабость, бесплодие.Диагностика основана на объективных данных клинического обследования половых органов, на определении низкого уровня в крови лютеинизирующего, фолликулостимулирующего и адренокортикотропного гормона, а также тестостерона. В моче определяется низкий уровень 17- оксикетокортикостероидов и 17-кетокортикостероидов.При лечении применяются препараты гонадотропных гормонов и кортикотропин. При выраженной андрогенной и глюкокортикоидной недостаточности необходима заместительная гормональная терапия андрогенами и глюкокортикоидами. Атаксия мозжечковая с гипогонадизмом. Наследственная болезнь, характеризующаяся мозжечковой атаксией и гипоплазией половых органов. Наследуется по аутосомно-рецессивному типу. RUD синдром. (от анг.: Retardation, underdeveloped gonads, dermatoses)Помимо гипогонадотропного гипогонадизма, характерно наличие врожденного ихтиоза, задержки умственного развития, гипосмия и наличие эпилепсии. Синдром Ротмунда-Томпсона характерно наличие задержки роста, гипогонадотропного гипогонадизма, анемии, контрактуры мягких тканей, гиподонтии, остеогенной саркомы. Синдром Мартсолфа включает наличие гипогонадотропного гипогонадизма, задержки роста и резко выраженной степени психического развития; характеризуется наследованием по аутосомно-рецессивному или Х-связанному типу и встречается чаще в еврейских семьях. Синдром Боресона-Форсмана-Леманахарактеризуется гипогонадотропным гипогонадизмом, резко выраженной степенью умственного развития, гипотонией, птозом, выступающими надбровными дугами и крупными глазами. Синдром недостаточности стероидной сульфатазы, помимо гипогонадотропного гипогонадизма, включает также односторонний агенез или гипоплазию почки, врожденный ихтиоз, нистагм, страбизм, гипопигментацию радужки и снижение остроты зрения; гипогонадизм сочетается с недостаточностью стероидной сульфатазы и арилсульфатазы С. Синдром Лави характеризуется сочетанием синдрома Фанкони с гипогонадотропным гипогонадизмом, а также с наличием катаракт, глаукомы, гипотонии и задержки психического развития. Charge синдром (от анг.: сoloboma, heart disease, atresia of choanae, retarded growth and development, genital hyperplasia, ear anomalies) характеризуется гипогонадотропным гипогонадизмом, колобомой, пороками сердца, атрезией улитки, задержкой роста и развития. Синдром Блума, проявляетсясочетанием недоразвития скелета, гипофизарной карликовости и гипогонадизма с врожденной телеангиэктатической эритемой лица, участками кератоза и гиперпигментации на туловище; проявляется в детском возрасте. Гемохроматоз (от греч. haima кровь + chromatos цвет, + -?sis; синоним: первичный идиопатический гемохроматоз, бронзовый диабет, сидерофилия, пигментный цирроз, синдром Труазье - Ано - Шоффара) - наследственная болезнь, характеризующаяся усиленным всасыванием железа в кишечнике и массивным накоплением его в разных тканях и органах, главным образом в печени. Встречается редко, преимущественно у мужчин. Типичные симптомы: общая слабость, артропатия, импотенция, пигментация кожи, гепатомегалия, гипогонадизм, признаки застойной сердечной недостаточности.Около 80% мужчин, больных гемохроматозом, имеют нарушение функции яичек. У этих пациентов гипогонадизм может развиваться вторично на фоне отложения железа в печени или может быть первичным, в результате отложения железа в ткани яичек. Отложения железа при гемохроматозе также обнаружены в гипофизе, что приводит к развитию гипогонадотропного гипогонадизма. Болезнь наследуется по рецессивному типу. Приобретённый гипогонадотропный гипогонадизм. Вторичный приобретенный гипогонадизмвозникает при поражении гипоталамуса или гипофиза различными патологическими процессами. Иногда избирательно страдает гонадотропная функция (адипозогенитальная дистрофия), чаще же всего поражается как гонадотропная, так и другие функции гипоталамо-гипофизарной системы. Диагноз вторичного приобретенного гипогонадизма чаще всего можно установить при компьютерной или магниторезонансной томографии. Типичным заболеванием, при котором развивается исключительно вторичный гипогонадотропный гипогонадизм является адипозогенитальная дистрофия. Адипозогенитальная дистрофия (болезнь Перхкранца - Бабинского - Фрелиха). Заболевание характеризуется сочетанием ожирения и гипогенитализмом. Как самостоятельное заболевание его можно рассматривать только в том случае, если симптоматика развивается в детском возрасте и причина заболевания неизвестна. Патологических изменений в гипоталамо-гипофизарной системе при явно выраженной клинической картине не наблюдается. Патогенез определяется недостаточностью гонадотропной функции гипофиза.
У детей адипозогенитальная дистрофия начинает проявляться с 10-12 лет. Ожирение характеризуется равномерным распределением жира с преимущественным отложением в области живота, таза, бедер, лица, груди (ложная гинекомастия). Лицо крупное, лунообразное, но без плеторы и высыпаний (как при болезни Иценко - Кушинга). Конечности относительно тонкие. Кожа нежная, сухая. Имеют место признаки гипогенитализма: мошонка и половой член гипоплазированы, яички уменьшены, описаны случаи крипторхизма. Формируются евнухоидные пропорции тела, половое оволосение скудное или отсутствует. Костный возраст отстает от истинного из-за задержки окостенения эпифизов. Наблюдается слабость связочного аппарата и костного скелета (плоскостопие, genu valgum, cubitas valgus). Co стороны внутренних органов отклонений нет. Иногда наблюдаются признаки несахарного диабета. Умственное развитие индивида не страдает, свойственна эмоциональная неустойчивость из-за сознания собственной неполноценности.
У взрослых наблюдается характерное ожирение, гипогонадизм и гипогенитализм, евнухоидные черты скелета, часто половая дисфункция и бесплодие. С возрастом, в связи с дистрофическими изменениями в сердце и гипотонией сосудов внутренних органов может развиваться одышка, метеоризм, дискинезия желчных путей.
При диагностике имеет значение наличие характерных признаков ожирения и гипогонадизма в препубертатном возрасте, когда ожирение при адипозогенитальном синдроме необходимо дифференцировать с алиментарным ожирением, при котором менее выражена задержка пубертата, исчезающая к периоду полового созревания.В отличие от других форм эндокринно-обменного ожирения, ожирение при адипозогенитальной дистрофии не является симптомом определенных заболеваний с четко выраженной специфической клинической картиной (болезнь Иценко - Кушинга, ожирение при гиперкортицизме, гипотиреозе, синдром Лоуренса - Муна - Бидля, синдром Морганьи - Стюарта - Мореля). Клиника адипозогенитальной дистрофии близка к синдрому Лоуренса - Муна - Бидля, однако при ней не наблюдается умственной отсталости и только для второй характерны врожденные аномалии (пигментный ретинит, шестипалость). От всех форм первичного гипогонадизма с ожирением адипозогенитальная дистрофия отличается низким уровнем гонадотропных гормонов.
Лечение медикаментозное. При выраженной андрогенной недостаточности назначается заместительная терапия тестостероном. Гипопитуитаризм.Это - сравнительно редкое заболевание, развитие которого связано со снижением или полным выключением функции передней доли гипофиза. Мы решили выделить гипопитуитаризм в отдельную нозологическую форму гипогонадотропного гипогонадизма, так как это заболевание, несомненно, отличается от остальных своеобразием клиники и особенностями терапии. В передней доле гипофиза происходит продукция шести гормонов (адренокортикотропин, пролактин, соматотропин, фоллитропин, лютропин и тиротропин). При гипопитуитаризме продукция всех гормонов гипофиза резко снижается или исчезает. В результате резко снижается функция периферических эндокринных желез, работу которых контролируют гормоны гипофиза.Гипопитуитаризм развивается в результате деструкции, разрушения передней доли гипофиза или гипоталамуса. При обширном некрозе передней доли гипофиза развивается болезнь Симмондса болезнь Симмондса, при менее глубоком некрозе - синдром Шихена.Болезнь Симмондса, диэнцефально-гипофизарная кахексия проявляется, прежде всего, прогрессирующим снижением веса тела, слабостью, адинамией, апатией, вялостью, снижение аппетита. Гипофункции щитовидной железы проявляется сухостью и бледностью кожных покровов, выпадением волос на голове, лобке и в подмышечных впадинах, выпадением бровей, ломкостью костей, отечностью лица, зябкостью, сонливостью, запорами. Надпочечниковая недостаточность обусловливает адинамию, гипотонию, склонность к гипогликемии, диспепсическим нарушениям. Диэнцефальная патология может проявляться нарушением сна, полидипсией, булимией.
Болезнь Шихена проявляется неодновременным и неравномерным выпадением тропных функций гипофиза. Начальными симптомами являются слабость, головокружения, анорексия. Часто на первый план в клинической картине выступают симптомы гипокортицизма. Истощения, в отличие от болезни Симмондса, не наблюдается.Клиническая картина полного гипопитуитаризма выявляется, когда остаются сохранными менее 10% функциональных клеток гипофиза.Гипопитуитаризм можно условно подразделить на первичный и вторичный.Первичный гипопитуитаризм является следствием разрушения или врожденного отсутствия клеток передней доли гипофиза, секретирующих гормоны.К вторичному гипопитуитаризму относят те случаи заболевания, когда недостаточность секреции гипофизарных гормонов вызвана конкретными заболеваниями с поражением гипоталамуса или высших отделов ЦНС. Первичный гипопитуитаризм. Гипоплазия и аплазия гипофизаГипоплазия гипофиза клинически протекает с недостаточностью или отсутствием секреции АКТГ и ТТГ. Описаны случаи полной аплазии гипофиза, которая встречается исключительно редко. При аплазии передней доли гипофиза определяются небольших размеров надпочечники, гипогенитализм и атрофия щитовидной железы. Задержка роста, которая встречается у таких больных, представляет большие трудности для лечения, в том числе гормоном роста человека. Наряду с этим имеются признаки поражения и других структур мозга, включая зрительный нерв.Краниофарингиома.Эта форма вторичного гипогонадизма обусловлена врожденной опухолью головного мозга, развивающейся из эмбриональных клеток гипофизарного хода - кармана Ратке.
Этиология опухоли неизвестна. При ее росте она сдавливает гипофиз. При сдавлении тканей гипофиза нарушаются его функции по выработке гормонов. При этом может быть снижена не только выработка гонадотропных гормонов, но и гормонов регулирующих функцию щитовидной железы и коры надпочечников. Реже наблюдается изолированное выпадение гонадотропной функции с типичной клинической картиной вторичного врожденного гипогонадизма.
Снижение синтеза всех гормонов аденогипофиза с детства приводит к отставанию в половом и физическом развитии, причем симптомы понижения продукции различных гормонов гипофиза могут появляться не одновременно. Клиническая картина зависит от степени недостаточности отдельных функций аденогипофиза. Продолжительность заболевания составляет от нескольких месяцев до 10-15 лет.
Нередко у больных встречается полидипсия, нарушение терморегуляции, аносмия, снижение зрения, то есть симптомы патологии гипоталамо-гипофизарной области головного мозга.
Клиническая симптоматика выпадения аденогипофизарных функций должна быть дополнена данными гормональных исследований мочи и крови. В 85% случаев современными методами обследования подтверждается дефицит гипофизарных тропных гормонов и гормонов периферических органов эндокринной системы.
Вторичный гипопитуитаризм.К развитию вторичного гипопитуитаризма приводят следующие заболевания.
- Аденомы гипофиза. Кровоизлияние в гипофизарную аденому или ее инфаркт.
- Опухоли гипоталамо-гипофизарной области: первичные (краниофарингиома, менингиома, глиома) и вторичные - метастазы злокачественных опухолей другой локализации (рак легких, молочной железы и др.).
- Гранулематозные заболевания: саркоидоз, болезнь Крисчена-Хенда-Шюллера, гистиоцитоз Х, туберкулез, сифилис.
- Сосудистые нарушения (послеродовые и другие кровотечения, приводящие к длительной гипотонии и спазму сосудов гипофиза, артерииты и аневризмы мозговых сосудов, кровоизлияние в гипофиз, тромбоз кавернозного синуса, синдром острой диссеминированной внутрисосудистой гемокоагуляции).
- Воспалительные заболевания: энцефалит, базальный менингит (в том числе туберкулезного происхождения), абсцессы, септический тромбоз кавернозного синуса.
- Повреждения гипоталамо-гипофизарной области (в том числе ятрогенные): травма черепа, гипофизэктомия, облучение гипоталамо-гипофизарной области, синдром 'пустого' турецкого седла, имплантация в гипофиз радиоактивного иттрия или золота, криохирургия гипофиза.
- Функциональные гипоталамо-гипофизарные нарушения, возникающие вторично при синдроме недостаточного всасывания в кишечнике (малабсорбция), сахарном диабете, голодании, нейрогенной анорексии, хронической почечной недостаточности и др. Эти изменения обратимы, и при ликвидации причин, вызвавших перечисленные состояния, восстанавливается секреция гормонов аденогипофиза.
Клиническая картина.При аденоме гипофиза на первый план выступают симптомы, развитие которых связано с наличием опухоли: головная боль, битемпоральная гемианопсия, снижение остроты зрения. Наиболее ранним из эндокринных симптомов является снижение гонадотропной функции гипофиза и гипогонадизма: снижение либидо и потенции, замедление роста волос на лице.При ишемическом некрозе аденогипофиза в первую очередь страдают гонадотропная функция гипофиза и секреция соматотропного гормона, уже затем недостаточность секреции тиреотропного и адренокортикотропных гормонов и пролактина. Если не проводится лечение, может наступить смерть от гипогликемической комы, которая развивается даже при нетяжелых интеркуррентных инфекциях.При супраселлярных процессах (гранулема, кисты, глиома в области перекреста зрительных нервов) характерным симптомом наряду с клиникой, описанной выше, являются наличие несахарного диабета, повышенная секреция пролактина, нарушение регуляции температуры, аппетита, сна, т.е. признаки изменения функции гипоталамуса. Наряду с перечисленными признаками часто наблюдаются и другие симптомы поражения ЦНС: сонливость, потеря интереса к окружающему, изменения личности, психозы. Выявляются изменения со стороны глазного дна (бледность или атрофия сосков зрительного нерва), битемпоральная гемианопсия, нарушение функции III или VI пары черепных нервов. Больные, страдающие гипопитуитаризмом, как правило, нормального питания (истощение наблюдается редко), кожа бледная, нежная, оволосение в подмышечных впадинах и на лобке скудное или отсутствует, наблюдается гипогенитализм и артериальная гипотония.Недостаточность секреции гонадотропинов в детском возрасте приводит к развитию гипогонадотропного гипогонадизма, ускоренному росту с евнухоидными пропорциями тела и задержкой пубертатного развития. У больных длительно не окостеневают гортанные хрящи, костный возраст отстает от паспортного, наблюдается задержка смены молочных зубов. Изменяется психика больных, многие из них озлоблены из-за физической и половой неполноценности. Подростки мужского пола рано начинают курить и увлекаться спиртными напитками. Снижение секреции гонадотропинов у мужчин сопровождается потерей либидо и потенции, уменьшением размеров яичек, азооспермией, выпадением волос на лице, в подмышечных впадинах, на лобке. Клиницистам хорошо известно, что одним из ранних симптомов снижения функции половых желез является понижение обоняния задолго до появления других признаков гипогонадизма. Недостаточность секреции соматотропного гормона в детском возрасте приводит к задержке роста различной степени, тогда как у взрослых специфическая симптоматика практически отсутствует. Однако может иметь место мышечная и сердечная слабость, боли в позвоночнике и костях вследствие различной степени остеопороза, при небольшом увеличении массы тела происходит изменение отношения массы мышц к массе жировой клетчатки из-за уменьшения общей массы мышц и увеличения общей массы жира. Наблюдаются повышение чувствительности к инсулину и тенденция к гипогликемиям. Недостаточность тиреотропного гормона в детском возрасте приводит к гипотиреозу, который сопровождается задержкой физического и психического развития. При снижении тиреотропной функции гипофиза появляются такие симптомы, как брадикардия, чувство зябкости, сухость кожных покровов, снижение моторики желудочно-кишечного тракта (запоры). Постоянна анемия, которая может быть микро -, нормо- или макроцитарной. Недостаточность секреции адренокортикотропного гормона является причиной гипоадренокортицизма («белый аддисонизм»). Больные пониженного питания, с «алебастровым» цветом кожи, резко выражена мышечная слабость. Наблюдается повышенная утомляемость, часто возникают тошнота и рвота. Со стороны сердечно-сосудистой системы отмечаются брадикардия, гипотония, ортостатические коллапсы. Гипогликемические состояния встречаются чаще, чем при аддисоновой болезни. Почти постоянно выявляется гипонатриемия. Различные стрессовые состояния (инфекция, нарушение функции желудочно-кишечного тракта и др.) приводят к развитию тяжелого коллапса и смерти. При поражении гипоталамических центров к сахарному диабету может присоединиться несахарный диабет, симптомами которого является жажда и полиурия.. Диагноз и дифференциальная диагностика.Клинический диагноз гипопитуитаризма должен быть подтвержден лабораторными исследованиями. Для выявления супра- или интраселлярной опухоли применяются рентгенография черепа и области турецкого седла, пневмоэнцефалография, ангиография, магниторезонансная или компьютерная томография. На серии рентгенограмм в этих случаях удается выявить признаки опухоли гипофиза: двойное или глубокое дно турецкого седла, его увеличение или асимметрия. При краниофарингиоме или остаточных явлениях туберкулезного менингита обнаруживается кальцификация. Изменения глазного дна и полей зрения, как правило, сочетаются с опухолями гипоталамо-гипофизарной области.Наряду с этим необходимо определение уровня гипофизарных гормонов и гормонов периферических желез в крови как при базальных условиях (натощак), так и на фоне проведения различных стимулирующих проб.Снижение гонадотропной функции гипофиза подтверждается определением уровня гонадотропинов и половых гормонов в крови, а также экскреции их с мочой. Уточнению характера тестикулярной недостаточности помогает проба с хорионическим гонадотропином, при гипогонадотропном гипогонадизме повышение уровня тестостерона составляет около 50% по сравнению с нормой. Большую диагностическую ценность представляет проба с кломифеном. Отсутствие реакции на кломифен позволяет заподозрить гипогонадизм гипофизарного или гипоталамического генеза. В некоторых случаях уточнению природы вторичного гипогонадизма помогает проба с гонадолиберином, который вводят внутривенно в дозе 2,5 мкг на 1 кг массы тела. Повышение гонадотропинов после стимуляции гонадолиберином указывает на наличие гипогонадизма в связи с поражением гипоталамуса.Недостаточность секреции соматотропного гормона подтверждается определением его уровня в сыворотке крови как натощак, так и при проведении различных стимулирующих проб (инсулиновая гипогликемия, инфузия аргинина, введение глюкагона). Исходный уровень соматотропного гормона в сыворотке крови ниже 1,5-2 нг/мл следует расценивать как признак недостаточности секреции гормона роста. После введения инсулина в дозе 0,1 Ед на 1 кг массы тела и снижения уровня глюкозы ниже 2,2 ммоль/л у практически здоровых лиц отмечается подъем концентрации соматотропного гормона выше 10 нг/мл. Отсутствие повышения соматотропного гормона выше 10 нг/мл указывает на недостаточность его секреции.Для выявления тиреотропной недостаточности гипофиза необходимо определение уровня тиреоидных гормонов и тиреотропного гормона в сыворотке крови. Высокое содержание тиреотропного гормона и низкий уровень тиреоидных гормонов в крови характерны для первичного гипотиреоза, тогда как при вторичном гипотиреозе выявляется низкая концентрация как тиреотропного гормона, так и тиреоидных гормонов. Кроме того, при вторичном гипотиреозе проба тиреотропным гормоном с введением 10 Ед тиреотропного гормона в течение 2-3 дней приводит к повышению уровня тиреоидных гормонов в крови.Недостаточность секреции адренокортикотропного гормона подтверждается определением уровня кортизола и адренокортикотропного гормона в сыворотке крови и экскреции кортикостероидов с мочой. Низкий уровень адренокортикотропного гормона и концентрации кортизола в крови натощак в 9 часов утра ниже 10 нг/л указывают на наличие недостаточности адренокортикотропного гормона. Для выявления резервов адренокортикотропного гормона проводится проба с инсулином. В ответ на инсулиновую гипогликемию у практически здоровых лиц повышается уровень адренокортикотропного гормона в крови, а содержание кортизола становится выше 590 нмоль/л. Внутримышечное введение вазопрессина в дозе 10 Ед также стимулирует высвобождение адренокортикотропного гормона с максимумом его концентрации в крови на 60-90-й минуте после введения препарата. Если инсулиновая гипогликемия оказывает стимулирующее действие на уровне гипоталамуса, то действие вазопрессина осуществляется на уровне гипофиза. Результаты этих проб могут помочь в некоторых случаях при дифференциальной диагностике гипокортицизма. Лечение гипопитуитаризма проводится с учетом причины, вызвавшей это заболевание. При опухолях гипоталамо-гипофизарной области в зависимости от вида опухоли показано хирургическое вмешательство или лечение с использованием ионизирующей радиации.Заместительная терапия проводится с учетом недостаточной секреции гипофизарных гормонов и гормонов периферических желез.При недостаточной секреции АКТГ больным назначают глюкокортикоиды. Препаратами выбора является производные кортизола в суточной дозе 10-30 мг (30 мг кортизола соответствует 7,5 мг преднизолона или преднизона, 37 мг кортизона, 0,75 мг дексаметазона или бетаметазона, 4 мг триамцинолона). С учетом ритма секреции кортизола 2/3 суточной дозы должно приходиться на утро - 7-8 часов и 1/3 суточной дозы на вечернее время. Для больных, страдающих гипопитуитаризмом, прием минералокортикоидов не рекомендуется в связи с тем, что секреция альдостерона у этих больных не нарушена.При выпадении гонадотропной функции гипофиза и гипофункции яичек проводится терапия гонадотропными гормонами, а при выраженной андрогенной недостаточности - препаратами тестостерона.При гипогонадотропном гипогонадизме у препубертатных мальчиков показана терапия гонадотропинами. В настоящее время для этих целей используют чаще всего хорионический и менопаузальный гонадотропин человека. Хорионический гонадотропин стимулирует клетки Лейдига и увеличивает секрецию тестостерона, а менопаузальный гонадотропин содержит почти в равных пропорциях лютеинизирующий и фолликулостимулирующий гормон и поэтому стимулирует не только синтез тестостерона, но и сперматогенез. После внутримышечного назначения хорионического гонадотропина в дозе 1500-6000 Ед нормальным взрослым мужчинам наблюдается двухфазовое повышение уровня тестостерона в сыворотке крови: первый пик через 2 часа после инъекции и второй, более продолжительный пик, через 72-96 ч после введения. Уровень тестостерона в сыворотке крови может оставаться повышенным после однократной инъекции хорионического гонадотропина в течение 6 дней. Одновременно отмечается такое же двухфазовое повышение уровня эстрадиола в сыворотке крови. Причем такое двухфазовое повышение указанных гормонов имеет место только у постпубертатных нормальных мужчин. У препубертатных мальчиков и гипогонадотропных мужчин, не леченных гонадотропинами, повышение уровня гормонов в крови после инъекции хорионического гонадотропина монофазовое с его пиком на 72-96-м часе после введения. Для лечения гипогонадотропного гипогонадизма хорионический гонадотропин обычно назначается внутримышечно в дозе 1500-2000 Ед 3 раза в неделю и уровень тестостерона в сыворотке крови определяется на 6-8-й неделе через 60-72 часа после последней его инъекции. Адекватность терапии определяется нормализацией уровня тестостерона в сыворотке крови. Наряду с этим должен осуществляться контроль сперматогенеза (спермограмма через каждый месяц), который должен восстановиться через 6-9 месяцев лечения. В том случае, если через 6-8 месяцев лечения хорионическим гонадотропином уровень тестостерона и сперматогенез не нормализуются, рекомендуется добавить к хорионическому гонадотропину менопаузальный гонадотропин, начиная с введения 1/2-1 ампулы, которая содержит по 75 Ед лютеинизирующего и фолликулостимулирующего гормонов. Через 3-4 месяца такого комбинированного лечения спермограмма должна иметь тенденцию к нормализации. Если такого не происходит, следует дозу менопаузального гонадотропина увеличить до 2 ампул. В большинстве случаев при таком лечении нормализация сперматогенеза отмечается через 1,5-2 года. В случае развития гипогонадотропного гипогонадизма у мужчин в постпубертатном периоде сперматогенез восстанавливается, как правило, после лечения хорионическим гонадотропином и не требуется введения менопаузального гонадотропина .Выше отмечалось, что для инициации и поддержания нормального высвобождения гонадотропинов из гипофиза необходима нормальная пульсирующая секреция гонадолиберина. Наличие коммерческих препаратов синтетического гонадолиберина позволило использовать его для лечения гипогонадотропного гипогонадизма. Гонадолиберин назначается в дозе 25 нг/кг (на каждый пульс) массы тела каждые 2 часа подкожно пульсирующим образом с помощью специального носимого дозатора-цикломата. Затем доза гонадолиберина может быть увеличена до 150-200 нг/мл на каждое пульсовое введение. Мониторинг уровня тестостерона, ЛГ и ФСГ в сыворотке крови позволяет установить индивидуальные дозы гонадолиберина. При появлении признаков пубертатного развития дозы гонадолиберина снижаются при сохранении нормальных показателей содержания тестостерона, лютеинизирующего и фолликулостимулирующего гормонов в сыворотке крови. При этом увеличивается объем яичек и количество сперматозоидов в эякуляте, что является объективным показателем нормализации сперматогенеза у больных.L. Liu и соавт. (1988) провели терапию в течение двух лет 2 групп больных, страдающих гипогонадотропным гипогонадизмом. Больные первой группы получали лечение гонадолиберином с помощью пульсирующего дозатора, а больные второй группы - хорионический гонадотропин и менопаузальный гонадотропин. Под влиянием терапии наблюдалось образование спермы до 5х10 млн/мл у 40% больных первой группы и у 80% второй группы. Таким образом, для индуцирования и поддержания сперматогенеза пульсирующая терапия гонадолиберином менее эффективна, чем традиционная заместительная терапия гонадотропинами. Попытка применения агонистов гонадолиберина для лечения гипогонадотропного гипогонадизма оказалась неудачной, так как после кратковременного стимулирующего эффекта наблюдается угнетение механизмом «обратной регуляции» секреции лютеинизирующего и фолликулостимулирующего гормонов гипофизом и снижение уровня тестостерона в сыворотке крови.Прогноз. При проведении адекватной заместительной терапии больные, страдающие гипопитуитаризмом, сохраняют трудоспособность и ведут нормальный образ жизни. Острый гипопитуитаризм. Изредка клиницистам приходится встречаться с синдромом остро развивающегося гипопитуитаризма, вызванным кровоизлиянием в опухоль или инфарктом опухоли гипофиза. Катастрофа возникает внезапно, сопровождается сильной головной болью, коллапсом и комой с наличием менингиальных симптомов, тахикардии и гипотонии. У некоторых больных могут присоединиться симптомы поражения III, IV и VI пар черепных нервов, нарушения зрения (дефекты полей зрения, изменения глазного дна). При поражении гипоталамических областей наблюдается повышение температуры тела и нарушение водного обмена. Правильной диагностике помогают наличие у больного с аденомой гипофиза клинической картины акромегалии, болезни Иценко-Кушинга. Кроме того, рентгенография черепа или компьютерная томография позволяет диагностировать опухоль турецкого седла, повышение внутричерепного давления.При кровоизлиянии в гипофиз требуется неотложная помощь. У больных, находящихся в коматозном состоянии, наиболее опасны для жизни симптомы недостаточности адренокортикотропного гормона и гормонов коры надпочечников (коллапс, гипотония), поэтому первые лечебные мероприятия должны быть направлены на борьбу с острой надпочечниковой недостаточностью. После взятия крови на содержание кортизола, не ожидая результатов исследования, внутривенно вводят 100-150 мг гидрокортизона и проводят инфузию 5% глюкозы и изотонического раствора хлорида натрия. При явлениях повышения внутричерепного давления по показаниям производится нейрохирургическая операция с целью декомпрессии, в период которой проводится энергичная терапия глюкокортикоидами. Нормогонадотропный гипогонадизм или гиперпролактинемический синдром. Гиперпролактинемия является биохимическим маркером гипоталамо-гипофизарной дисфункции. В общей популяции распространённость этого состояния составляет около 0,5% у женщин и 0,07% - у мужчин. Чаще всего гиперпролактинемия встречается у мужчин в возрасте 25-40 лет. Синдром гиперпролактинемии - это сочетание гиперпролактинемии со снижением либидо, потенции и бесплодием у мужчин. Данный синдром мужчин также носит название гиперпролактинемического гипогонадизма.Особенности секреции и регуляции повышения уровня пролактинаПролактин является полипептидным гормоном, секретирующимся в пролактотрофах передней доли гипофиза, которые составляют от 11 до 29% всего клеточного состава аденогипофиза и концентрируются, главным образом, в его заднелатеральной области.У человека секреция повышения уровня пролактина имеет пульсирующий характер - выявлены отчётливые изменения секреции в течение дня, которые не контролируются циркадным ритмом: постоянное повышение уровня пролактина отмечается в течение сна, независимо от того, когда это происходит - днём или ночью. Увеличение уровня пролактина отмечается через 60-90 минут после засыпания и не связано с определённой стадией сна. После пробуждения концентрации уровня пролактина в плазме резко уменьшаются, достигают наименьших значений в поздние утренние часы и имеют тенденцию увеличиваться после полудня. Однако эти колебания уровня повышения пролактина в течение дня в не стрессовых состояниях всегда находятся в пределах нормального диапазона.Секреция уровня повышения пролактина находится под сложным нейроэндокринным контролем, в котором участвуют различные по своей природе агенты: нейромедиаторы, биологически активные нейропептиды, гормоны периферических эндокринных желез.Факторы, участвующие в регуляции секреции уровня повышения пролактина, можно условно разделить на две группы: пролактин - ингибирующие - дофамин, гамма аминомасляная кислота, гастрин, соматостатин, гонадотропинсвязывающий белок и пролактин-стимулирующие - серотонин, тиреотропин-рилизинг гормон, гонадотропин-рилизиг гормон, вазоинтестинальный пептид, опиаты (энкефалин, бета-эндорфин, метэнкефалин), нейротензин и субстанция Р., окситоцин, ангиотензин П.Главным физиологическим пролактин-ингибирующим фактором является дофамин, который синтезируется в гипоталамическом тубероинфундибулярном дофаминергическом тракте. Нейроны последнего расположены в области дугообразного и перивентрикулярного ядер медиобазальной области гипоталамуса. Дофамин оказывает пролактин - ингибирующее действие на уровне аденогипофиза через систему высокоспецифичных рецепторных структур, локализованных на мембранах лактотрофов. Идентифицировано два типа рецепторов - Д1 и Д2. Рецепторы типа Д1 стимулируют аденилатциклазу, а рецепторы Д2 - угнетают. Дофамин и его антагонисты стимулируют Д2 рецепторы, что приводит к ингибированию аденилатциклазы, уменьшению количества внутриклеточного цАМФ с соответствующим снижением высвобождения и биосинтеза повышения уровня пролактина. Дофамин угнетает также деление клеток и синтез ДНК, что сопровождается исчезновением секреторных гранул в пролактотрофах и стимулированием процессов кринофагии. Поэтому в лечении гиперпролактинемии часто с успехом используются различные агонисты дофамина.Гиперпролактинемия у мужчин отражает нарушение нормального механизма физиологического торможения секреции повышения уровня пролактина.На секрецию повышения уровня пролактина оказывают влияние йодтиронины щитовидной железы и эстрогены. Влияние тироксина и эстрогенов косвенное: они изменяют число рецепторов тиреотропин-рилизинг гормона на лактотрофах. Тироксин по механизму отрицательной обратной связи снижает, а эстрогены увеличивают их число. Эстрогены также стимулируют экспрессию гена повышения уровня пролактина, поэтому у женщин до менопаузы концентрация повышения уровня пролактина в сыворотке выше, чем у мужчин или у женщин после менопаузы.Нарушение регуляции лактотропной функции гипофиза чаще всего проявляется неконтролируемым повышением секреции повышения уровня пролактина, которое приводит к развитию синдрома гиперпролактинемии.Причины гиперпролактинемииСиндром гиперпролактинемии является проявлением, как самостоятельного гипоталамо-гипофизарного заболевания, так и одним из самых распространённых синдромов при различных эндокринопатиях, соматогенных и нервно-психических нарушениях. Физиологические и патологические причины гиперпролактинемии. Физиологические причины.
- медицинские манипуляции
- физические упражнения
- сон
- гипогликемия
- психологический стресс
- раздражение соска молочной железы
- приём белковой пищи
Патологические причины.Заболевания гипоталамуса:
- опухоли (краниофарингиома, герминома, гамартома, глиома, опухоль III желудочка мозга, метастазы)
- инфильтративные заболевания (гистиоцитоз Х, саркоидоз, туберкулёз)
- псевдоопухоль мозга
- артериовенозные пороки
- облучение гипоталамической области
- повреждение ножки гипофиза (синдром перерезки ножки гипофиза)
Заболевания гипофиза:
- пролактинома
- смешанная аденома (соматотропин - и пролактин-секретирующая)
- аденомы гипофиза (соматотропин -, адренокортикотропин-, тиреотропин- или гонадотропин-секретирующая, клинически гормонально-неактивная аденома). Синдром «пустого» турецкого седла.
- краниофарингиома.
- интраселлярная киста
- киста кармана Ратке
- интраселлярная герминома
- интраселлярная менингиома
Другие заболевания:
- первичный гипотиреоз
- хронический простатит
- ХПН
- цирроз печени
- недостаточность коры надпочечников
- врождённая дисфункция коры надпочечников
- опухоли, продуцирующие эстрогены
- повреждения грудной клетки
- эктопированная секреция гормонов (апудомами, лимфоцитами, эндометрием)
- идиопатическая гиперпролактинемия
Фармакологические средства, приводящие к гиперпролактинемии.
фармакологическая группа
препараты
Ингибиторы рецепторов дофамина
Нейролептики из групп фенотиазина (левомепромазин, перициазин, тиоридазин, трифлуоперазин, хлорпромазин), бутирофенона (бенперидон, галоперидол, дроперидол), тиоксантена (зуклопситиксол, флупентиксол, хлорпротиксен), бензамидов (сульпирид), дифенилбутилпиперидина (пимозид) Противорвотные средства (домперидон, метоклопрамид)
Исчерпывающие запасы дофамина
Резерпин
Ингибиторы синтеза дофамина
Метилдопа, карбидопа, леводопа, бенсеразид
Тормозящие метаболизм дофамина и его секрецию в срединном возвышении
Опиаты, морфин, героин, кокаин
Антагонисты гистаминовых Н2-рецепторов
Циметидин, ранитидин, фамотидин
Трициклические антидепрессанты, ингибиторы захвата моноаминооксидазы
Амитриптилин, кломипрамин, доксепин, импрамин, меклобемид
Эстрогены
Гормональные контрацептивы
Стимуляторы серотонинергической системы
Амфетамины, галлюциногены
Антагонисты кальция
Верапамил
Патологические причины
Заболевания гипоталамуса.
Патологические процессы в гипоталамусе и воронке (ножке) гипофиза могут сопровождаться гиперпролактинемией, которая в данном случае связана с разрушением эндосупраселлярной опухолью гипофиза, вызывающей компрессию или повреждение (перерезку) ножки гипофиза, гипоталамических тубероинфундибулярных дофаминергических нейронов и/или блокадой доставки дофамина к портальной системе.
Пролактиномы
Микропролактиномы (меньше 10 мм в диаметре) и макропролактиномы (больше 10 мм в диаметре) представляют наиболее часто встречаемую аденому гипофиза и наиболее частую причину гиперпролактинемии. Обычно уровни повышения пролактина при пролактиномах чрезвычайно высоки (больше 4000 мЕд/л), с уровнями в пределах от 800 до 500000 мЕд/мл. У мужчин по сравнению с женщинами пролактинома встречается менее часто (1: 6-10). Однако, как правило, гиперпролактинемия у мужчин сочетается с наличием макроаденом. Микроаденомы у мужчин встречаются исключительно редко
Первичный гипотиреоз
Повышенные уровни пролактина выявляются у пациентов с первичным гипотиреозом почти в 40% случаев. Эти нарушения обычно нормализуются соответствующей заместительной терапией тиреоидными гормонами.
Хронический простатит.
При хроническом простатите больные часто жалуются на снижение половых функций, в том числе и снижение полового влечения, а при гормональном исследовании в крови выявляется увеличенная концентрация уровня пролактина.
Хроническая почечная недостаточность.
При хронической почечной недостаточности гиперпролактинемия встречается всего у около 30% больных и у около 80% больных с терминальной стадией хронической почечной недостаточности, которым проводится гемодиализ.
Цирроз печени
Умеренная гиперпролактинемия может встречаться у пациентов с циррозом печени.
Эктопическая секреция пролактина.
Эктопическая гиперпролактинемия - чрезвычайно редкое явление. Некоторые опухоли, например, бронхогенные раки и гипернефромы, могут секретировать повышение уровня пролактина. В литературе имеется описание всего нескольких случаев.
Идиопатическая гиперпролактинемия.
Пациенты с умеренной гиперпролактинемией (500-1600 мЕд/мл), но без рентгенологических (компьютерная томография, магнитно-резонансная томография) признаков микроаденомы и/или гипоталамо-гипофизарной патологии, часто рассматриваются как имеющие «идиопатическую» или «функциональную» гиперпролактинемию.
Клинические проявления гиперпролактинемии
Клиника гиперпролактинемии широко варьирует от случая к случаю, начиная от отсутствия каких-либо клинических нарушений, когда гиперпролактинемия выявляется случайно, до наличия всех симптомов, которые в основном включают в себя репродуктивные, сексуальные, метаболические и эмоционально-личностные нарушения, а при макропролактиноме - признаки и симптомы наличия объёмного процесса в гипоталамо-гипофизарной области.
Репродуктивные и сексуальные нарушения
Поскольку как у женщин, так и у мужчин повышение уровня пролактина основную роль играет в регуляции репродуктивной функции, то гиперпролактинемия, как правило, и в первую очередь, приводит к нарушениям этой системы - формированию синдрома гипогонадизма.
У мужчин проявлениями гиперпролактинемии могут быть снижение или отсутствие либидо и потенции (50-85%), уменьшение вторичных половых признаков (2-21%), бесплодие вследствие олигоспермии (3-15%), гинекомастия (6-23%). Галакторея встречается очень редко (0,5-8%), вероятно, в связи с отсутствием предварительной стимуляции грудных желез эстрогенами. У 15% мужчин с пролактин-секретирующей аденомой гипофиза клиническая симптоматика может отсутствовать, и опухоль выявляется случайно при проведении компьютерной томографии или магнитно-резонансной томографии головного мозга по другим показаниям.
Часто причиной для первого посещения врача у большинства мужчин с пролактиномой является снижение остроты зрения и/или ограничение полей зрения, то есть имеет место более поздняя диагностика на стадии зрительных нарушений.
Симптомы объёмного процесса в гипоталамо-гипофизарной области.
Супраселлярный рост опухоли приводит к компрессии хиазмы зрительных нервов, что проявляется ограничением полей зрения (битемпоральной верхней квадрантопсией, а позже гемианопсией).
Головная боль часто сопутствует гиперпролактинемии опухолевого генеза, но этиология её всё ещё неясна. Одним из возможных механизмов является натяжение твёрдой мозговой оболочки (диафрагмы седла) экспансивно-растущей опухолью.
Метаболические нарушения.
Помимо нарушения половой и репродуктивной функций, у нелеченых женщин и мужчин с гиперпролактинемией прогрессивно уменьшается костная масса и развивается сопровождающийся болями остеопороз, причём выраженность этих симптомов уменьшается при нормализации уровней повышения пролактина и половых гормонов в сыворотке крови. У около 40-60% пациентов с гиперпролактинемией отмечается различной степени ожирение, нередко сопровождающееся инсулинорезистентностью.
Психоэмоциональные нарушения.
Эмоционально-личностные расстройства, как правило, склонность к депрессии, нарушение сна отмечается у около 20-30% больных. Жалобы неспецифического характера - повышенная утомляемость, слабость, снижение памяти, боли в области сердца без чёткой локализации и иррадиации наблюдаются у 15-25% пациентов.
Диагностика гиперпролактинемии
Базальные уровни повышения пролактина в сыворотке крови у мужчин взрослых составляют в среднем 140 мЕд/л. В большинстве лабораторий верхний уровень в норме находится в пределах 400-500 мЕд/л.
Для того чтобы правильно установить диагноз, должно быть проведено несколько определений повышения уровня пролактина в сыворотке крови, особенно при наличии незначительной гиперпролактинемии, поскольку повышение уровня пролактина имеет пульсирующий характер секреции и чувствителен к различным стрессорным ситуациям, в том числе и к венепункции. Гиперпролактинемия устанавливается при наличии увеличенных концентраций уровня пролактина в сыворотке крови.
Показаниями к определению уровня повышения пролактина в сыворотке крови являются: бесплодие, снижение либидо и потенции у мужчин, гинекомастия и галакторея у мужчин; задержка полового развития у мальчиков; любое образование гипоталамо-гипофизарной области, выявленное при магнитно-резонансной томографии или компьютерной томографии; состояние после операции по поводу любого образования гипоталамо-гипофизарной области.
Оценить секрецию пролактина позволяют пробы с тиролиберином и метоклопрамидом (церукалом).
Проба с метоклопрамидом (церукалом).
Церукал является антагонистом дофамина центрального действия и стимулирует секрецию пролактина. Метоклопрамид вводят внутривенно в дозе 10 мг, кровь для определения пролактина берут в следующие временные интервалы: 0, 15, 30, 60, 120 мин. Помимо внутривенного теста можно использовать прием 120 мг метоклопрамида внутрь с последующим определением пролактина через каждые 30 минут в течение 4 часов. В норме в ответ на введение метоклопрамида уровень пролактина в сыворотке крови увеличивается в 10-15 раз по сравнению с исходными цифрами. При пролактиноме содержание пролактина в ответ на метоклопрамид практически не изменяется, тогда, как при функциональной гиперпролактинемии отмечается дальнейшее повышение уровня пролактина по сравнению с исходными цифрами, но оно значительно ниже показателей, наблюдаемых в норме.
Проба с тиролиберином.
Тиролиберин в дозе 250-500 мкг вводят одномоментно внутривенно, кровь для определения пролактина берут на 0, 15, 30, 60, 120-й минутах. В норме пик повышения пролактина в крови в ответ на тиролиберин наблюдается на 15-30-й минуте и в 4-8 раз превышает его исходную концентрацию. При пролактиноме ответ на введение тиролиберина резко снижен или отсутствует, а при гиперпролактинемии, вызванной другими причинами, - в норме или снижен, но при этом суммарный прирост пролактина достоверно выше, чем при наличии пролактиномы.
Кроме того, определенную трудность в плане диагностики представляет псевдопролактинома. Выделение этой формы проведено лишь в последние годы, когда для лечения пролактинемии стали широко применяться препараты производные спорыньи. Псевдопролактинома характеризуется макроаденомой гипофиза, умеренным повышением пролактина в крови и отсутствием эффекта на препараты производных спорыньи (бромокриптина). Агонисты дофамина могут ингибировать содержание пролактина у больных с пролактиномой и псевдопролактиномой. Однако уменьшение размеров аденомы гипофиза наблюдается лишь при пролактиноме.
Проба с домперидоном.
Кроме того, для дифференциальной диагностики этих заболеваний предложена проба с домперидоном, который вводится внутривенно в дозе 10 мг. У больных с истинной пролактиномой (микроаденома или макроаденома) в ответ на введение препарата отмечается повышение содержания тиреотропного гормона в сыворотке крови, тогда как при псевдопролактиноме такое повышение отсутствует.
Лечение.
Терапия зависит от причины, вызвавшей гиперпролактинемию. Однако независимо от причины заболевания целью лечения являются снижение и нормализация повышенной секреции пролактина, уменьшение размеров аденомы гипофиза, коррекция гипогонадизма и лактореи, восстановление зрения и функции черепных нервов в случае их нарушения.
Если гиперпролактинемия связана с приемом лекарственных средств, перечисленных ранее, дальнейшее лечение этими препаратами должно быть прервано. Через 4-5 недель после их отмены восстанавливается нормальный уровень пролактина.
Препаратами выбора для лечения синдрома гиперпролактинемии являются препараты, относящиеся к производным спорыньи, в частности, это препарат бромкриптин (парлодел). Обычно бромкриптин переносятся больными хорошо, но у некоторых больных могут быть побочные эффекты в виде тошноты, рвоты, постуральной гипотонии. Для предупреждения перечисленных явлений препарат следует назначать с небольших доз с постепенным увеличением дозы до терапевтической. В последние годы разработаны длительно действующие препараты бромкриптина, которые применяются внутримышечно в дозе 50-200 мг 1 раз в месяц. Доза препарата подбирается индивидуально под контролем содержания пролактина в крови, добиваясь его нормального уровня на протяжении указанного времени.
Часть пациентов с гиперпролактинемией резистентна к парлоделу и для снижения его уровня требуются большие дозы - до 30-40 мг в сутки, что, естественно, связано со значительными побочными явлениями (головные боли, резко выраженная общая слабость, боли в животе, запоры и даже галлюцинации). С учетом этого разработан новый дофаминовый D2-агонист, не относящейся к производным спорыньи - норпролак, который нормализует содержание пролактина у больных, резистентных к бромкриптину. Под влиянием норпролака нормализуется также секреция гонадотропинов.
Помимо медикаментозной терапии, для лечения гиперпролактинемии применяются хирургическое вмешательство и радиотерапия. Гипофизэктомия проводится посредством трансфеноидального доступа с использованием микрохирургии. Показаниями к хирургическому вмешательству служат большая, разрушающая турецкое седло опухоль, супраселлярный рост опухоли с симптомами сдавления перекреста зрительных нервов, пролактинома, резистентная к медикаментозной терапии. После удаления пролактиномы уровень пролактина в сыворотке крови нормализуется уже через несколько часов. Нормализация уровня пролактина в крови имеет место у 60-90% больных с микропролактиномами. У больных с макропролактиномами эффективность операции ниже (20-40%). В последней группе более часто развивается послеоперационный гипопитуитаризм.
Радиотерапия (протоновый пучок, гамма-терапия и др.) применяется чаще всего как дополнительный метод лечения после гипофизэктомии или неполной нормализации секреции пролактина на фоне медикаментозной терапии.
У больных с гиперпролактинемией, развитие которой связано с гипотиреозом или недостаточностью надпочечников, заместительная терапия соответствующими гормонами приводит к нормализации секреции пролактина. Как правило, дополнительного назначения дофаминовых агонистов не требуется.
Благодаря новым методам исследования (компьютерная и МРТ томография) при так называемой функциональной гиперпролактинемии выявляются микроаденомы, а создание инструментария и разработка технологий оперативного лечения микроаденом гипофиза позволили улучшить результативность лечения этой патологии.
Возрастной андрогенный дефицит (синдром PADAM).
"Кто хотя бы раз узнал обо всех положительных моментах, привносимых в жизнь заместительной гормональной терапией, тот безо всякого страха будет применять гормональную терапию и дальше, веря в то, что это позволит ему прожить дольше и лучше" (B.Lunenfeld, 2001)
Жизнь можно сравнить с планером, с которого нас катапультируют в 20 лет на самую вершину наших врожденных физических и умственных способностей, снабдив, однако, запасом гормонов, тестостерона и эстрогенов. И затем, когда мы уже скользим вниз по потоку жизни, наш спуск во многом зависит от того, насколько хорошо наш организм балансирует гормонами. Гормоны стресса - адреналин, норадреналин и кортизол - увеличивают износ организма, количество потребляемой нами энергии, то есть оказывают катаболическое (разрушающее) действие. А другие, например, тестостерон и эстрогены, наоборот, имеют противоположное анаболическое (созидающее) действие. Этим и объясняется, почему некоторые люди очень быстро сгорают, стрелой летя вниз, а некоторые плавно парят, достигая 80 и даже 100 лет.
По данным ООН, средняя продолжительность жизни в развитых странах неуклонно растет, в прошлом веке она увеличилась с 49 до 79 лет и к 2010 г., как прогнозируется, составит 85 лет. В развитых странах это сопровождается уменьшением численности молодых людей и детей. Таким образом, проблема "старения" общества диктует необходимость продления активной жизни человека, что позволит снизить все возрастающие затраты на содержание и лечение нетрудоспособных пожилых людей. Причем речь идет не столько о продлении жизни в целом, сколько о повышении ее качества.
Тестостерон играет определяющую роль в социальной жизни мужчины. Мужчины, имеющие более высокий уровень тестостерона, не только более успешны в социальной жизни, но они также нуждаются и в более высоком уровне тестостерона для поддержания своей активности. В связи с этим даже появилось понятие "индивидуальной нормы тестостерона". Иногда тестостерон называют гормоном победителей. Уровень его в крови повышается после одержанной в борьбе победы, после удачного решения каких-то проблем. Чувство удовлетворения и праздничное настроение, охватывающие победителя, притормаживают образование стрессовых гормонов, обеспечивших достижение победы, и в тоже время происходит усиленное выделение тестостерона.
Физическая, сексуальная и социальная активность - это наиболее важный фактор в профилактике старения. Уровень тестостерона снижается прогрессивно с возрастом, исключая мужчин из жизненной активности. Возраст, когда общепринято назначать заместительную гормональную терапию является возраст после 65 лет. Но почему? Известно, что снижение уровня тестостерона наблюдается после 30 лет и дефицит тестостерона приводит к клиническим проявлениям с социальными последствиями на 15-20 лет раньше. Почему необходимо ждать, чтобы мужчина постарел и только потом предотвращать его дальнейшее старение? Не лучше ли позаботиться о его здоровье гораздо раньше, а далее лишь поддерживать его на должном уровне? Почему следует дожидаться снижения тестостерона, приводящему к старению и развитию возраст - ассоциированных заболеваний, и предотвращать дальнейшее его падение только в последние годы жизни? В этом контексте, следует ли воздерживаться от лечения молодых мужчин с андрогенной недостаточностью в возрасте 40-45 лет и моложе? Ведь термин «пожилой человек» очень неоднозначен. Возникает вопрос, кто является пожилым человеком: мужчина в возрасте 70 лет с хорошим физическим, психическим и сексуальным состоянием, активно занимающийся спортом, или пациент пятидесятилетнего возраста, страдающий сахарным диабетом, перенесшим инфаркт миокарда, полный импотент и не способный к минимальной физической нагрузке?
Парадоксально, что мужчины боятся использовать гормональные препараты, хотя известны их прекрасные эффекты заместительной гормональной терапии у женщин. Почему мужчины, должны лечиться с двадцатилетним промедлением, т.е. в возрасте 65 лет и более, если клинические проявления демонстрируют необходимость более раннего лечения? Что необходимо сделать для поддержания молодости и хорошего самочувствия в течение длительного времени? Большинство стареющих мужчин нуждаются в поддержании высокого качества жизни, что неразрывно связано с необходимостью повышения уровня тестостерона.
Основное количество тестостерона в организме мужчин циркулирует в плазме в связанном с белками виде: с альбумином и глобулином (SHBG). Только около 2% тестостерона находится в несвязанной, свободной форме. Биологически активными фракциями тестостерона являются свободная и связанная с альбумином.
По данным Vermeulen А., наиболее признанного авторитета в области фундаментальных исследований возрастного андрогенного дефицита в здоровой популяции мужчин, средний уровень общего тестостерона в плазме существенно не меняется до 50-55 лет, а затем снижается со скоростью примерно 1 % в год. Биологически активные фракции тестостерона, главным образом, свободный тестостерон, начинают снижаться в более раннем возрасте, уже примерно с 35 лет.

По данным Массачусетского исследования, проводившегося у пожилых мужчин, уровень биологически активного тестостерона начинает снижаться уже с 30-35 лет со скоростью около 2-3% в год, а уровень общего тестостерона с 50-55 лет на 0,8-1,6% в год.
Так, в возрасте 80 лет средний уровень общего тестостерона плазмы составляет около 60%, а свободного - всего 20% от такового в возрасте 20 лет. Такая разница в уровне фракций тестостерона может быть объяснена увеличением с возрастом у мужчин содержания секс-стероидсвязывающего глобулина (SHBG) - примерно на 1,6% в год - приводящим к относительному росту неактивной формы гормона. Однако, несмотря на падение уровня общего тестостерона, его концентрация в некоторых случаях не выходит за нижние пределы нормы (< 12 нмоль/л). По этой причине и принята формулировка "частичный андрогенодефицит", показывающая, что абсолютного гипогонадизма нет, а происходит значительное снижение уровня гормона по сравнению с отмечавшимся у пациента в более молодом возрасте.
Существует множество терминов для обозначения процессов, происходящих в мужском организме с возрастом: "пенопауза", "виропауза", "андропауза". Но широкое распространение получил именно термин "частичный андрогенодефицит пожилых мужчин" (PADAM - partial androgen deficiency in aging male), который более полно отражает происходящие изменения.
Причины возрастного андрогенного дефицита.
1. Первичное поражения клеток Лейдига в яичках.
С возрастом происходит уменьшение числа этих клеток, снижение плотности рецепторов к лютеинизирующему гормону на этих клетках, а также активности ферментов метаболического пути синтеза тестостерона.
2. Десенситизация клеток Лейдига к лютеинизирующему гормону.
При изучении секреции лютеинизирующего гормона у пожилых мужчин было обнаружено, что амплитуда пиков выбросов гормона уменьшена, а частота - повышена по сравнению с таковыми у молодых мужчин, что ведет к десенситизации клеток Лейдига к стимулирующему влиянию лютеинизирующего гормона. Происходит нарушение пульсовой секреции тестостерона, при сохранной базальной. При введении экзогенного гонадотропин рилизинг-гормона ритм секреции лютеинизирующего гормона восстанавливался, что указывает на первичное нарушение на уровне гипоталамуса.
Поэтому причиной возникновения дефицита андрогенов у пожилых мужчин, скорее всего, являются как нарушение на уровне клеток Лейдига, так и дизрегуляция в системе гипоталамус - гипофиз, т.е. гипогонадизм имеет смешанный характер.
Диагностика возрастного андрогенного дефицита.
Диагностика возрастного андрогенного дефицита должна проводиться в 4 этапа.
Первый этап - первичная диагностика возрастного андрогенного дефицита.
Второй этап - лабораторный этап диагностики возрастного андрогенного дефицита.
Третий этап - пробная заместительная терапия тестостероном 1-2 месяца.
Четвертый этап - отмена заместительной терапии на 1-2 месяца.
Первый этап.
Первичная диагностика возрастного андрогенного дефицита проводится на первичном приеме, где оцениваются субъективные и объективные симптомы снижения уровня андрогенов, а также проводится стандартное анкетирование с определением степени выраженности андрогенного дефицита.
Симптомы снижения уровня андрогенов можно разделить на несколько групп.
Половая система:
- Снижение либидо
- Эректильная дисфункция
- Уменьшение яркости оргазма
- Уменьшение полового оволосения
- Уменьшение объема и плотности яичек
Психо-эмоциональная и вегетативная нервная система
- Повышенная раздражительность
- Снижение способности к концентрации внимания
- Снижение когнитивных функций, памяти
- Депрессия
- Бессонница
- Уменьшение "жизненной энергии"
- Вазомоторные нарушения (внезапная гиперемия лица, шеи, верхней части туловища, чувство жара - "приливы", колебания уровня артериального давления, кардиалгии, головокружения, чувство нехватки воздуха, повышенная потливость)
Опорно-двигательный аппарат и жировая ткань:
- Снижение мышечной массы и силы
- Увеличение количества жировой ткани
- Остеопороз
- Снижение тонуса и толщины кожи ("дряблость" кожи)
Другие системы:
Гинекомастия 
Понижение уровня тестостерона в первую очередь увеличивает раздражительность мужчины, которая не только мешает мужчине вступать в сексуальные контакты, но и делает его непривлекательным для партнерши. В отделении исследований репродуктивных систем человека при Совете медицинских исследований Британии было проведено исследование, в результате которого выяснилось, что факторы, влияющие на раздражительность баранов, оказывают аналогичное воздействие на мужчин.
При исследовании синдрома раздражительности баранов, проявляющегося в зимний период, выяснилось, что воздействию этого синдрома в той же мере подвержены и мужчины. В результате исследования было обнаружено, что изменения в поведении баранов в сторону раздражительности вызваны сезонным падением уровня гормона тестостерона в крови на зимний период. Осенью уровень мужского гормона поднимается в крови баранов, подстегивая их к спариваниям и игривости. Зимой, когда уровень гормона в крови падает, бараны утрачивают половое влечение и становятся нервными, замкнутыми и иррационально агрессивными. Как оказалось, недостаток мужского гормона тестостерона в крови может вызвать изменения в поведении мужчин, делая их раздражительнее и заставляя испытывать приступы подавленного настроения. Но, в отличие от женской менопаузы, угнетенное настроение и приступы раздражительности могут поразить мужчину любого возраста при недостатке тестостерона в крови.
Для оценки симптомов возрастного андрогенного дефицита используется опросник для оценки андрогенного статуса мужчины
"Опросник симптомов старения мужчины" (AGM Aging Males Symptoms)
Симптомы
нет
слабые
умеренные
выраженные
Очень выраженные
1. Ухудшение общего самочувствия и общего состояния (общее состояние здоровья, субъективные ощущения)
1
2
3
4
5
2. Боли в суставах и мышечные боли (боли в нижней части спины, боли в суставах, в пояснице, боли во всей спине)
1
2
3
4
5
3. Повышенная потливость (неожиданные/ внезапные периоды повышенного потоотделения, приливы жара, независимые от степени напряжения)
1
2
3
4
5
4. Проблемы со сном (трудности с засыпанием, на протяжении сна, раннее пробуждение, чувство усталости, плохой сон, бессонница)
1
2
3
4
5
5. Повышенная потребность во сне, частое ощущение усталости.
1
2
3
4
5
6. Раздражительность (ощущение агрессивности, раздражение по пустякам, уныние)
1
2
3
4
5
7. Нервозность (внутреннее напряжение, суетливость, беспокойство)
1
2
3
4
5
8. Тревожность (приступы паники)
1
2
3
4
5
9. Физическое истощение/упадок жизненных сил (общее снижение работоспособности, пониженная активность, отсутствие интереса к занятиям досуга, сниженная самооценка, неудовлетворенность сделанным, необходимость заставлять себя проявлять активность)
1
2
3
4
5
10. Снижение мышечной силы (ощущение слабости)
1
2
3
4
5
11. Депрессия (чувство подавленности, грусти, слезливость, отсутствие стимулов, колебания в настроении, чувство бесполезности)
1
2
3
4
5
12. Ощущение, что жизненный пик пройден.
1
2
3
4
5
13. Опустошенность, ощущение, что дошел до ручки
1
2
3
4
5
14. Уменьшение роста бороды.
1
2
3
4
5
15. Снижение способности и частоты сексуальных отношений.
1
2
3
4
5
16. Снижение частоты наступления утренних эрекций.
1
2
3
4
5
17. Снижение сексуального желания/либидо (отсутствие удовольствия от секса, отсутствие желания сексуальных контактов)
1
2
3
4
5
Наблюдаете ли Вы у себя какие-либо другие симптомы?
2
Оценка симптомов андрогенного дефицита: 17-26 баллов - невыраженная симптоматика, 27-36 баллов - слабовыраженная симптоматика, 37-49 баллов - средней выраженности симптоматика, более 50 баллов - выраженная симптоматика.
Второй этап.
При выявлении признаков андрогенной недостаточности по данным первичного обследования и анкетирования проводится лабораторная диагностика андрогенной недостаточности.
Обязательно исследование уровня пролактина и тиреотропного гормона, так как гиперпролактинемия и заболевания щитовидной железы, помимо специфической, имеют схожую симптоматику андрогенного дефицита. По показаниям исследуются гормоны гипофиза (кроме лютеинизирующего), гормоны щитовидной железы и надпочечников.
Центральное значение имеет исследование тестостерона крови, его фракций, секс-стероидсвязывающего глобулина (SHBG) и альбумина.
При явном гипогонадизме необходимо измерение лютеинизирующего гормона, так как при высоких цифрах этого гормона назначение гонадотропных препаратов нецелесообразно.
Анализу подлежит утренняя порция крови, так как синтез тестостерона имеет циркадные ритмы. Колебания в течение дня могут доходить до 35%, при этом максимум приходится на утренние часы.
При уровне общего тестостерона ниже 8 нмоль/л или свободного тестостерона ниже 180 пмоль/л необходима заместительная гормональная терапия. Поскольку симптомы дефицита тестостерона начинают проявляться при его концентрации в диапазоне 8-12 нмоль/л, решение о назначении терапии должно быть принято для тех конкретных пациентов, у которых исключены другие причины имеющихся симптомов гипогонадизма.

Манифестацию недостаточности тестостерона можно сравнить с кардиогенным шоком, при котором падение артериального давления составляет 1/3 от привычного уровня. Клинические наблюдения показывают, что падение артериального давления и уровня тестостерона мужчины чувствуют примерно одинаково. Вставая утром с постели, они находят мокрую подушку, подобно пациентам в состоянии шока.
Уровень тестостерона варьирует индивидуально и его необходимо сравнивать с уровнем тестостерона в 30-35 летнем возрасте. В возрасте 20-25 лет уровень тестостерона выше, но поддержание такого высокого уровня тестостерона у пожилых мужчин нефизиологично и необоснованно. Однако этот уровень должен стать точкой отсчета.
Третий и четвертый этап. Пробная заместительная терапия тестостероном и временная отмена заместительной терапии.
Даже при наличии явных клинических и лабораторных признаков андрогенной недостаточности у врача, а чаще всего у пациента, остаются сомнения в необходимости пожизненной терапии тестостероном. Мужчина не может с этим смириться - «Как это всю оставшуюся жизнь?». Кроме того, эти сомнения подогревают широко распространенные мифы о вредности лечения гормонами, их губительное влияние на сердечно-сосудистую систему, печень, предстательную железу.
Назначение пробного лечения и его отмена имеет две цели:
Первая - подтвердить клинический и лабораторно установленный диагноз андрогенного дефицита благоприятными изменениями физического, сексуального и психо-эмоционального состояния пациента в ответ на восполнение дефицита тестостерона в организме. Это своеобразный завершающий этап диагностики андрогенного дефицита.
Вторая цель - продемонстрировать пациенту различия его самочувствия при дефиците мужского полового гормона и при его нормальных значениях. При этом на финише диагностической программы мужчина сам делает ответственный выбор дальнейшего стиля жизни - жизни активной или прозябания.
При этом врач обязан не только предложить программу терапии тестостероном и подобрать наиболее приемлемый для пациента препарат, но и составить программу динамического наблюдения и обследования и информировать обо всех потенциальных рисках.
Каковы же цели заместительной гормональной терапии?

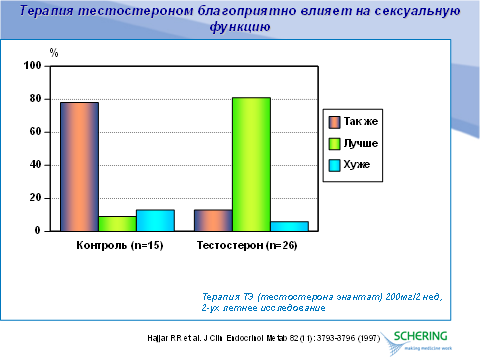
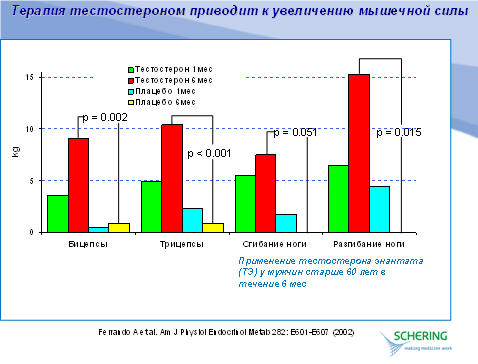
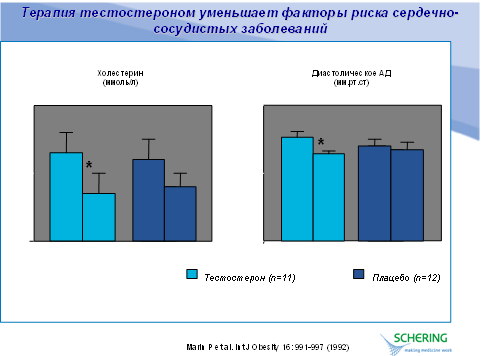

Лечение возрастного андрогенного дефицита.
В лечении основную роль должна играть терапия, направленная на нормализацию содержания тестостерона в плазме крови. Повысить содержание тестостерона можно двумя способами: проведением либо заместительной терапии андрогенами, либо стимулирующей терапии хорионическим гонадотропином.
Если в основе гипогонадизма у мужчины лежит повышение активности ароматазы жировой ткани, то предпочтение отдается препаратам тестостерона, не подвергающимся ароматизации (местеролон или провирон).
Вид терапииПрепаратЗаместительная терапияПрепараты тестостеронаСтимулирующая терапияПрепараты хорионического гонадотропинаСнижающая периферический метаболизм тестостеронаПрепараты тестостерона, не подвергающиеся ароматизацииАндрогены.Основной целью заместительной терапии тестостероном является:
- - снижение симптомов возрастного андрогенодефицита путем повышения либидо, общей сексуальной удовлетворенности, уменьшения выраженности или исчезновения вегетососудистых и психических расстройств;
- - при длительном лечении (более 1 года) - повышения плотности костной массы, уменьшения выраженности висцерального ожирения, нарастания мышечной массы;
- - нормализации лабораторных параметров: повышение уровня гемоглобина или количества эритроцитов, снижение уровня ЛПОНП и ЛПНП при неизмененном уровне ЛПВП.
Андрогены, используемые для заместительной гормональной терапии.
Химическое название
Торговое название
Дозировка
Инъекционные
Тестостерона ципионат
Депо-тестостерона ципионат
200-400 мг каждые 3-4 недели, в/м
Тестостерона энантат
Деластерил Тестовирон, Тестостерон депо
200-400 мг каждые 2-4 недели, в/м
Смесь эфиров тестостерона
Сустанон 250
250 мг каждые 3 недели, в/м
Тестостерона фенилпропионат
Тестостерона изокапроат
Тестостерона деканоат
Тестостерона ундеканоат
Небидо
1000 мг каждые 10-12 недель, в/м
Пероральные
Флуоксиместеролон
Галотестин
5-20 мг ежедневно
Метилтестостерон
Метандрен
10-30 мг ежедневно
Тестостерона ундеканоат
Андриол
120-200 мг ежедневно
Местеролон
Провирон Вистинон, Вистимон
25-75 мг ежедневно
Буккальные таблетки
Стриант
30 мг 3 раза в день
Подкожные
Импланты тестостерона
---
1200 мг каждые 6 месяцев
Трансдермальные
Пластыри с тестостероном (скротальные и накожные)
Андродерм
Тестодерм
2,5-7,5 мг ежедневно
10-15 мг ежедневно
Тестостерон-гель
Андрогель Тестогель
25-50 мг ежедневно
Тестостерон-крем
Андромен
20 мг ежедневно
Дигидротестостерон-гель
Андрактим
25 мг ежедневно
На протяжении некоторого времени применялись такие пероральные андрогенные препараты, как флуоксиместеролон и метилтестостерон. Эти препараты являются 17-a-алкилированными соединениями, которые обладают серьезными побочными эффектами - токсическим и канцерогенным влиянием на печень, а также отрицательным действием на липидный спектр крови (резкое повышение уровня атерогенных и снижение уровня антиатерогенных липопротеидов). В связи с этим, применение 17-алкилированных производных тестостерона в клинической практике было прекращено.
Из пероральных препаратов в настоящее время предпочтение отдается тестостерону ундеканоату (Андриол). Данный эфир тестостерона не подвергается первичному печеночному метаболизму, так как всасывается в лимфатическую систему, минуя печень. После гидролиза тестостерона ундеканоата в лимфатической системе в системный кровоток поступает тестостерон, который оказывает лечебное действие как сам по себе, так и через свои основные метаболиты - дигидротестостерон (ДГТ) и эстрадиол, обусловливающие полный спектр андрогенной активности тестостерона. Таким образом, тестостерона ундеканоат сохраняет свою активность при пероральном применении. Вместе с этим, минуя систему воротной вены и прохождение через печень, тестостерона ундеканоат не оказывает гепатотоксического и гепатоканцерогенного действия. Период полувыведения препарата из плазмы составляет 3-4 часа. В связи с этим, режимом дозировки тестостерона ундеканоата является 2-кратный прием в течение суток, что может представлять некоторые неудобства для пациентов. Андриол является достаточно мягким препаратом и помогает только в случаях минимального андрогенного дефицита.
Местеролон (провирон), являясь химически модифицированным аналогом дигидротестостерона, не ароматизируется в эстрогены, поэтому пациентам с ожирением, у которых андрогендефицитное состояние сопровождается гиперэстрогенемией из-за повышения ароматазной активности в жировой ткани, предпочтительнее назначать данный препарат, хотя по сравнению с препаратами других групп он не обладает полным спектром биологических эффектов и достаточной эффективностью. Провирон назначают в суточной дозе 50-75 мг под контролем уровней, как тестостерона, так и эстрадиола, которые должны находиться в пределах нормальных показателей.
Внутримышечные инъекции пролонгированных эфиров тестостерона также являются широко применяемым методом заместительной терапии у мужчин с гипогонадизмом. Два наиболее известных эфира тестостерона - тестостерона ципионат и тестостерона энантат, имеют похожую фармакокинетику. При внутримышечном введении этих препаратов создается депо, из которого препарат высвобождается в кровеносное русло. В течение первых 2-3 дней после введения уровень тестостерона повышается до супрафизиологических цифр, а затем медленно снижается на протяжении последующих 2 недель до субнормальных значений. Положительной стороной этих препаратов является длительность терапевтического действия. Тем не менее, резкие изменения в уровне тестостерона, зачастую ощущаемые самим пациентом в виде подъемов и снижения либидо, общего самочувствия, эмоционального статуса являются нежелательными качествами данных препаратов.
В настоящее время разработан современный препарат для лечения андрогенной недостаточности и гипогонадизма - НЕБИДО.
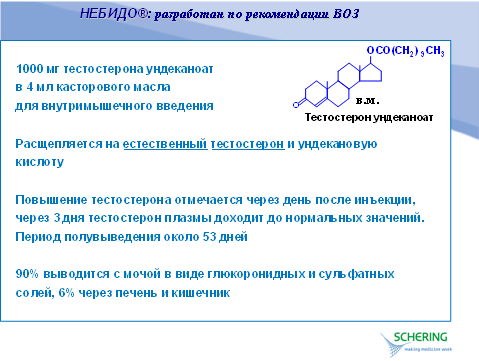

В некоторых странах, преимущественно в Австралии и Англии, широкое распространение получили подкожные импланты тестостерона. Проведение данной процедуры требует разреза кожи троакаром. И, хотя действие препарата продолжается до 6 месяцев, временами может происходить самоэкстракция импланта, а также возникать инфекция в месте инвазивного вмешательства.
Трансдермальный путь введения тестостерона позволяет избежать его первичного метаболизма в печени и инактивации, как это происходит при применении пероральных андрогенных препаратов, а также позволяет имитировать циркадные ритмы высвобождения физиологического немодифицированного тестостерона и его естественных метаболитов, эстрадиола и ДГТ.
1. Мошоночные и накожные пластыри обладают эффективным действием, и некоторые пациенты считают их наиболее удобным методом лечения. Они дают эффективный уровень тестостерона в сыворотке крови. Тем не менее, существуют некоторые различия между этими двумя разновидностями пластырей относительно их аллергогенного потенциала. При применении накожных пластырей отмечается гораздо большая частота возникновения аллергических реакций и раздражения кожи, чем при применении мошоночных пластырей.
2. Гель тестостерона (АндроГель) обладает всеми преимуществами пластырей, а местные реакции при использовании геля минимальны. Применение АндроГеля позволяет нормализовать содержание тестостерона в течение нескольких часов после нанесения препарата, а также поддерживать стабильный его уровень на протяжении всего периода применения. Тестостерон в виде геля всасывается с поверхности кожи и поступает в кровоток, при этом постоянная концентрация в плазме наблюдается в течение 24 часов. Его недостаток заключается в наличии возможности контакта геля с партнершей.
3. Дигидротестостерон-гель (Андрактим). Дигидротестостерон-гель в некоторых странах признан эффективным средством заместительной гормональной терапии. Хотя и неизвестно, создает ли изолированное применение неароматизированного андрогена (каким является дигидротестостерон), такое же действие, как тестостерон, в связи с тем, что метаболиты тестостерона включают и эстрадиол. По мнению многих авторов, применение препарата не рекомендуется, так как дигидротестостерон вследствие невозможности превращения в эстрадиол не обладает полным спектром терапевтических свойств тестостерона (например, влиянием на костную ткань и сердечно-сосудистую системы).
Таким образом, существует множество препаратов заместительной андрогенотерапии, однако, все они имеют те или иные побочные эффекты, а также обладают угнетающим действием на сперматогенез.
Противопоказания для проведения заместительной гормональной терапии тестостероном.
Абсолютные противопоказания:
- рак предстательной железы
- рак молочной железы
Относительные противопоказания:
- ночное апноэ
- полицитемия
- гинекомастия
- задержка жидкости и отеки
- нарушение сперматогенеза
Препараты аналоги гонадотропных гормонов.
Назначаясь внутримышечно, препараты тестостерона приводят к значительным изменениям концентрации тестостерона, иногда не физиологичным.
При оральном использовании препаратов изменение концентрации тестостерона в крови держится в течение короткого периода времени. При имплантации препаратов тестостерона создается не физиологически распределенная концентрация тестостерона во времени. Транскутанные формы дороги и вызывают местные реакции.
Однако это не является особо важной проблемой. В физиологических условиях в клетках Лейдига синтезируется много половых стероидов: андрогены, эстрогены, прогестерон. К чему приводит назначение экзогенного тестостерона? Блокируется синтез лютеинизирующего гормона. А снижение концентрации лютеинизирующего гормона ингибирует синтез всех остальных половых стероидов в яичках. Воздействие эндогенного тестостерона, синтезируемого под воздействием хорионического гонадотропина, представляется более физиологичным.
В случаях с гипогонадотропным гипогонадизмом, а также возрастным андрогенодефицитом предпочтение следует отдавать хорионическому гонадотропину, стимулирующему секрецию собственного тестостерона клетками Лейдига.
Цель заместительной терапии хорионическим гонадотропином - стимуляция сперматогенеза и синтеза эндогенного тестостерона, в случае сохранения такой способности яичками, с поддержанием его уровня в нормальных пределах, что проявляется в исчезновении признаков андрогенной недостаточности.
Хорионический гонадотропин вначале назначается в дозе 1000 Ед. внутримышечно 1 раз в 4- 5 дней. Через 1 месяц оценивается его эффективность с помощью контроля уровня тестостерона крови (12-33 нмоль/л). При недостаточности доза постепенно увеличивается на 500 Ед. ежемесячно.
Исследование 150 мужчин с андрогенной недостаточностью продемонстрировало, что после назначенияхорионического гонадотропина в дозе 2000 Eд каждые 3-4 дня в течение месяца, базовая концентрация тестостерона выросла более чем в 2 раза.
Кроме того, наблюдается сохранение эффекта применения хорионического гонадотропина у ряда пациентов в течение 1-6 месяцев после прекращения приема препарата, что является положительным дополнительным моментом применения данной терапии.
Препараты хорионического гонадотропина, используемые для лечения андрогенной недостаточности.
Препарат
Дозировка
Гонадотропин хорионический
500, 1000 Ед. в 1 флаконе
Бигонадил
200, 500 Ед. в 1 флаконе
Хорагон
1500, 5000 Ед. в 1 флаконе
Гонадотрофен
50, 2000, 10000 Ед. в 1 флаконе
Прогнил
100, 500, 1500, 3000 Ед в 1 флаконе
Профази
500, 1000, 2000, 5000 Ед в 1 флаконе
Овитрель
250 мкг во флаконе (соответствует 6500 Ед)
Противопоказания для проведения заместительной гормональной терапии хорионическим гонадотропином.
Абсолютные противопоказания:
- рак предстательной железы
- рак молочной железы
Относительные противопоказания:
- гиперчувствительность к препарату
- опухоли гипофиза
- тяжелая сердечная недостаточность
- почечная недостаточность
- бронхиальная астма
- эпилепсия
- отрицательные результаты пробы с ХГ (отсутствие повышения тестостерона более чем на 50% на введение ХГ) являются противопоказанием для дальнейшего его использования в связи с неэффективностью
Рекомендации Международной ассоциации стареющих мужчин (ISSAM) по лечению возрастного андрогенного дефицита.
В выработке рекомендаций принимали участие представители следующих ассоциаций: Международная ассоциация андрологов (ISA), Международная ассоциация стареющих мужчин (ISSAM) и Европейская ассоциация урологов. Авторы: E. Nieschlag, K. Swerdlof, H.M. Behre, L.T. Gooren, T.M. Kaufman, T.T. Legros, B. Lunenfeld, T.E. Morley, C. Schulman, C. Wang, W. Weidner и F.C.W.Wu.
Рекомендация 1.
Определение возрастного гипогонадизма.
(Late onset hypogonadism, LOH). Клинический и биохимический синдром, ассоциированный с пожилым возрастом и характеризующийся типичными клиническими симптомами и дефицитом циркулирующего тестостерона. Это может приводить к существенному ухудшению качества жизни, оказывать неблагоприятное влияние на функцию целого ряда систем организма.
Рекомендация 2.
Возрастной гипогонадизм как синдром характеризуется следующим:
- Легко распознаваемыми признаками - снижением либидо, ухудшением качества и частоты эрекции, особенно ночной эрекции.
- Изменением настроения с сопутствующим снижением интеллектуальной активности, когнитивной функции.
- Нарушением сна.
- Снижением мышечной массы тела, ассоциированной с уменьшением её объема и силы.
- Увеличением висцеральной жировой ткани.
- Уменьшением волосяного покрова и изменением тургора кожи.
- Снижением минеральной плотности кости с развитием остеопении, остеопороза и увеличением риска переломов.
Рекомендация 3.
У пациентов с предполагаемым гипогонадизмом обязательно должно быть проведено клиническое и биохимическое обследование. Специальные биохимические исследования должны быть выполнены в следующем объеме:
-
- Определение концентрации общего тестостерона в сыворотке крови и секс-стероид связывающего глобулина (SHBG), для чего необходимо взятие венозной крови в промежутке 07.00 и 11.00 часов. Для подтверждения наличия гипогонадизма наиболее приемлемым параметром является определение уровня общего тестостерона и определение концентрации свободного тестостерона, используя математический расчет или его определение надежным методом равновесного диализа.
- В настоящее время нет всеми приемлемой величины нижней границы нормы общего тестостерона. Тем не менее, имеется общее согласие, что при уровне общего тестостерона выше 12 нмоль/л или уровне свободного тестостерона выше 250 пмоль/л не требуется назначения заместительной терапии. Окончательно, основываясь на данных, полученных у молодых взрослых мужчин, достигнут консенсус, что при уровне общего тестостерона ниже 8 нмоль/л или свободного тестостерона ниже 180 пмоль/л необходима заместительная терапия препаратами тестостерона. Поскольку симптомы дефицита тестостерона начинают проявляться при его концентрации в диапазоне 8-12 нмоль/л, решение о назначении терапии должно быть принято для тех конкретных пациентов, у которых исключены другие причины имеющихся симптомов гипогонадизма.
- Определение концентрации свободного тестостерона в слюне является достаточно надежным подходом. Однако данная методология требует дальнейшей стандартизации. Нормативы для взрослых мужчин в большинстве клиник и референсных лабораториях пока отсутствуют.
- В тех случаях, когда уровень тестостерона ниже или меньше нижней границы приемлемого нормального уровня тестостерона, характерного для мужчин, рекомендуется провести вторичное определение тестостерона, а также исследовать содержание в сыворотке лютеинизирующего гормона и пролактина.
Рекомендация 4.
-
- Общеизвестно, с возрастом ассоциированы изменения функции других эндокринных систем, однако достоверная значимость этих изменений все ещё мало понятна. В принципе, определение гормонов щитовидной железы, кортизола, дигидроэпиандростерона и его сульфатной формы, мелатонина, гормона роста и инсулиноподобного фактора роста-1 не требуется при определении возрастного гипогонадизма. Однако, в тех случаях, когда есть клинические симптомы соответствующих эндокринных нарушений, требуется определение вышеназванных гормонов, равно как и ряда других.
- Сахарный диабет второго типа часто встречается у пожилых мужчин. В настоящее время не ясно, какой эффект оказывает тестостерона на уровень глюкозы крови и на чувствительность к инсулину; поэтому лечение, прежде всего, должно быть направлено на компенсацию диабета, при этом возможно также и назначение препаратов тестостерона в случае наличия его дефицита у пациента.
- У стареющих мужчин с жалобами на эректильную дисфункцию необходимо исследовать липидный спектр сыворотки и состояние сердечно-сосудистой системы.
Рекомендация 5.
Четкими показаниями, основанными на клинических симптомах в комплексе с биохимическим подтверждением низкого уровня циркулирующего тестостерона должен располагать врач, прежде чем назначить заместительную терапию препаратами тестостерона.
Рекомендация 6.
- Терапия тестостерона абсолютно противопоказана мужчинам, у которых подозревается или уже диагностирован рак простаты и грудной железы.
- Мужчинам с выраженной полицетемией, нелеченным синдромом ночного апноэ, с патологией сердца и серьезными симптомами обструкции нижних мочевых путей, особенно вследствие доброкачественной гиперплазии простаты, противопоказано назначение заместительной терапии препаратами тестостерона. Незначительная обструкция не является абсолютным противопоказанием для проведения такой терапии. После успешного лечения обструкции, противопоказания снимаются.
- В случае отсутствия определенных противопоказаний, возраст пациента как таковой, не является противопоказанием для назначения заместительной терапии тестостероном.
Рекомендация 7.
- Препараты естественного тестостерона должны использоваться для заместительной терапии. Все доступные в настоящее время препараты тестостерона для внутримышечного, подкожного, внутрикожного введения, а также для орального и защечного введения являются безопасными и эффективными. Лечащий врач должен обладать достаточными знаниями и конкретным пониманием фармакокинетики, равно как и быть информирован о положительных и побочных эффектах каждого препарата. Выбор препарата должен проводиться совместно врачом и пациентом.
- В случае возникновения противопоказаний в процессе лечения (особенно карциномы предстательной железы) требуется быстрое прекращение заместительной терапии тестостероном. Препараты короткого действия (трансдермальные, оральные, защечные) у пациентов с возрастным гипогонадизмом должны быть предпочтительными по сравнению с длительно действующими (внутримышечные, подкожные).
- Имеется недостаточно данных для того, чтобы определить на каком уровне необходимо поддерживать циркулирующий тестостерон в процессе заместительной терапии с учетом её эффективности и безопасности. На данный момент наших знаний необходимо стремиться поддерживать концентрацию тестостерона в крови на уровне, характерном для мужчин молодого возраста. Важно избегать суперфизиологического уровня тестостерона. Несмотря на желательность поддерживать суточный ритм тестостерона, к этому не надо стремиться при проведении заместительной терапии.
Рекомендация 8.
- 1 . Алкилзамещенные препараты тестостерона, такие как 17a-метилтестостерон абсолютно противопоказаны, так как они обладают гепатотоксическим действием и поэтому не должны назначаться пациентам.
- Недостаточно данных к настоящему времени, чтобы рекомендовать проведение заместительной терапии пожилым мужчинам дигидротестостероном, равно как и другими стероидами, такими как дегидроэпиандростерон, дегидроэпиандростерон сульфат, андростендиол и андростендион.
- Хорионический гонадотропин (ХГЧ) стимулирует продукцию тестостерона клетками Лейдига, однако у стареющих мужчин этот эффект слабее, чем у молодых. Поскольку недостаточно информации об эффективности и побочных эффектах лечения хорионического гонадотопина у пожилых мужчин, то его использование не рекомендуется для терапии возрастного андрогенного дефицита.
Рекомендация 9.
Улучшение признаков и симптомов дефицита тестостерона должно быть тщательно прослежено и в случае отсутствия положительной динамики, ухудшения состояния пациента, терапия тестостероном должна быть прекращена.
Рекомендация 10.
Ректальное пальпаторное исследование предстательной железы и определение в сыворотке простатического специфического антигена (ПСА) обязательно у мужчин старше 45 лет, равно как определение объема железы, прежде чем будет назначена терапия тестостероном . В первые 12 месяцев лечения состояние простаты исследуется ежеквартально, а затем раз в год. Трансректальная биопсия предстательной железы под контролем ультразвука показана только в том случае, если результаты ректальной пальпации и уровень ПСА в сыворотке указывают на возможную карциному предстательной железы.
Рекомендация 11.
Терапия тестостероном обычно сопровождается повышением настроения и улучшением общего самочувствия. Появление существенных негативных отклонений в поведении больного при лечении тестостероном диктует необходимость модификации дозы препарата или прекращения терапии.
Рекомендация 12.
Полицетемия периодически развивается в процессе лечения тестостероном. Периодическое гематологическое исследование необходимо, например, перед назначением терапии, каждые 3 месяца в течение первого года, а затем один раз в год. Возможно, потребуется изменение дозы препарата.
Рекомендация 13.
Плотность костной ткани увеличивается в процессе заместительной терапии, возможно уменьшение частоты переломов. Поэтому оценка плотности костной ткани желательна с интервалом один раз в 2 года.
Рекомендация 14.
У некоторых пациентов с эректильной дисфункцией и низким уровнем тестостерона , лечение одним тестостероном не приносит положительного результата. В этом случае дополнительно в терапию можно включить ингибиторы фосфодиэстеразы-5. И наоборот, пациенты с эректильной дисфункцией и низким уровнем тестостерона, которые не отвечают положительно на ингибиторы фосфодиэстеразы, требуют включения в терапию дополнительно препаратов тестостерона.
Рекомендация 15.
Пациенты, которым успешно проведена терапия по поводу опухоли предстательной железы и у которых развился клинический гипогонадизм, являются кандидатами на заместительную терапию тестостероном, спустя достаточный срок после завершения лечения опухоли простаты. При этом необходимо исключить наличия остаточной опухоли. Пациент должен быть информирован о возможном риске, равно как о положительных эффектах такой терапии. В этом случае пациент должен находиться под тщательным наблюдением. Нет надежных аргументов «за и против» данной рекомендации. Врач должен иметь хороший опыт и знания для принятия решения в каждом конкретном случае.
Риски заместительной терапии тестостероном у стареющих мужчин.
В настоящее время рак предстательной железы является одной из наиболее распространенных форм рака у мужчин, частота возникновения которого достигает пика в возрастной группе около 70 лет. Причем при проведении аутопсии рак простаты обнаруживается гораздо чаще, чем проявляется клинически. В недавнем прошлом зафиксирован рост случаев рака простаты, особенно у мужчин в возрасте старше 60 лет, отчасти - за счет улучшения методов скрининговой диагностики.
Наибольшие опасения относительно клинического применения у мужчин заместительной терапии андрогенами вызывает общепринятое мнение о негативном влиянии андрогенов на предстательную железу и, особенно, о возможной стимуляции андрогенами рака предстательной железы. Эти данные основываются на фактах о гормональной чувствительности рака предстательной железы. Еще 60 лет назад было показано, что подавление секреции тестостерона ведет к регрессу рака предстательной железы. И в настоящее время устранение действия андрогенов с помощью блокаторов рецепторов андрогенов, аналогов гонадотропин-рилизинг гормона, ингибиторов 5 -редуктазы является стандартом лечения пациентов раком предстательной железы. Однако взаимосвязь между раком предстательной железы и андрогенами до настоящего времени изучена недостаточно, особенно много вопросов вызывает роль андрогенов в его возникновении.
Общепринято, что для развития доброкачественной гиперплазии и рака простаты необходимо присутствие функционирующих яичек, что, однако, не подразумевает прямую корреляцию между уровнем андрогенов и риском возникновения этих заболеваний. Несомненно, андрогены влияют на развитие, поддержание размеров и функциональную активность предстательной железы. Ведь предстательная железа атрофируется после кастрации и восстановление функции наблюдается после назначения терапии андрогенами. В последнее время, многими независимыми исследователями было выявлено отсутствие четкой корреляции между уровнем тестостерона и развитием карциномы простаты (Sih R 1997; Snyder PJ 1999). Более того, в ряде исследований была выявлена положительная корреляция низкого уровня свободного тестостерона и развития карциномы (Juenemann K.P 2002; Lungmayr G. 2002). В Массачусетском исследовании по изучению старения мужчин было обнаружено, что вариации в уровне гормонов (тестостерона общего, свободного, андростендиона, эстрадиола, дигидротестостерона) только в 11% связаны с риском возникновения рака простаты, в то время как другие факторы - питание и иммунные показатели - в 30% и 40 %, соответственно.
Нет пока четких данных и о негативном влиянии тестостерона на развитие уже имеющейся субклинической карциномы, выявляемой только при биопсии. Как показано рядом исследователей, терапия андрогенами ведет либо к отсутствию, либо к минимальному увеличению простаты на фоне незначительного повышения уровня простатического специфического антигена (Gann PH 1996; Sih R 1997).
Достаточно интересная работа была проведена E. L. Rhoden, A. Morgentaler (2003) «Заместительная тестостеронотерапия у мужчин с гипогонадизмом и высокий риск рака предстательной железы: результаты однолетнего исследования у мужчин с простатической интраэпителиальной неоплазией». Терапия андрогенами назначалась мужчинам с интраэпиталиальной неоплазией простаты на протяжении 1 года. Данное исследование показало, что терапия тестостероном у мужчин с интраэпителиальной неоплазией не ведет к статистически значимому повышению уровня простатического специфического антигена и не повышает риск возникновения рака предстательной железы. Авторы делают вывод, что наличие у мужчины интраэпиталиальной неоплазии не является противопоказанием к проведению андрогенотерапии.
В исследовании Hoffman MA, DeWolf WC, Morgentaler A. (2000). «Является ли низкий уровень свободного тестостерона маркером поздних стадий рака простаты?» были получены данные о связи низкого уровня свободного тестостерона и наиболее агрессивных проявлений рака простаты.
По материалам:
Категория: Андрология
|
|
Мы рекомендуем Вам зарегистрироваться либо войти на сайт под своим именем.








